
 尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.酪氨酸结构简式如图所示,下列关于酪氨酸的说法不正确的是( )
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.酪氨酸结构简式如图所示,下列关于酪氨酸的说法不正确的是( )| A、酪氨酸的分子式为C9HllNO3 |
| B、酪氨酸能发生缩聚反应生成高分子化合物 |
| C、酪氨酸能与溴水发生取代反应 |
| D、1mol酪氨酸能和2 molNaHCO3反应 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
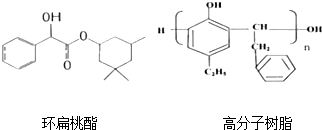
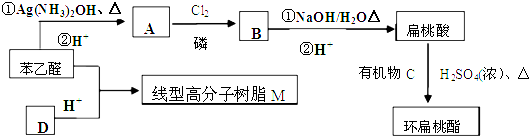
查看答案和解析>>
科目:高中化学 来源: 题型:
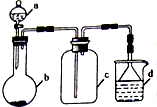 硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.| 序号 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| 甲 | 浓硫酸 | Na2SO3 | ① | ② |
| 乙 | 浓硝酸 | Cu | ③ | NaOH |
| 丙 | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
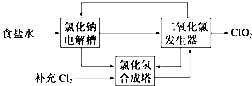
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
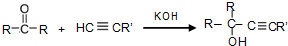
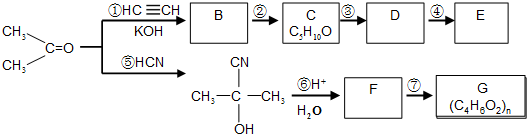
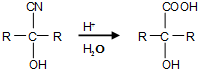
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、制取等量的硝酸铜,需硝酸的量②最少 |
| B、制取等量的硝酸铜,②产生的有毒气体比①少 |
| C、三种方案中,硝酸的利用率为③>①>② |
| D、三种方案的反应都可以在铁质容器中进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com