
| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
分析 平衡时各物质的平衡浓度的关系为ca(A)•c(B)=c(C)•c(D),则平衡常数K=1,若温度不变,将容器的体积缩小为原来的$\frac{1}{2}$,A 的转化率没有发生变化,说明增大压强平衡不移动,则a+1=1+1,故a=1,设转化的B的物质的量为xmol,表示出平衡时各组分物质的量,结合平衡常数列方程计算解答.
解答 解:平衡时各物质的平衡浓度的关系为ca(A)•c(B)=c(C)•c(D),则平衡常数K=1,若温度不变,将容器的体积缩小为原来的$\frac{1}{2}$,A 的转化率没有发生变化,说明增大压强平衡不移动,则a+1=1+1,故a=1,
设转化的B的物质的量为xmol,则:
A(g)+B(g)?C(g)+D(g)
起始量(mol):1 2 0 0
转化量(mol):x x x x
平衡量(mol):1-x 2-x x x
反应前后气体的物质的量不变,可以用物质的量代替浓度计算平衡常数,故$\frac{x×x}{(1-x)×(2-x)}$=1,解得x=$\frac{2}{3}$,故B的转化率为$\frac{\frac{2}{3}mol}{2mol}$×100%=33.3%,
故选:C.
点评 本题考查化学平衡计算,涉及平衡常数计算及应用,关键是判断a的值,难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
 以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
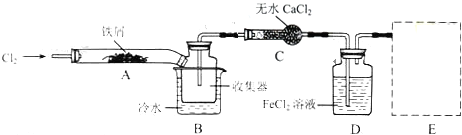
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com