
| A. | 常温常压下,4.4g CO2物质的量为0.1mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1NA个H2O分子含有氧分子数为1mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
分析 A.根据n=$\frac{m}{n}$计算出4.4g二氧化碳的物质的量;
B.根据n=$\frac{m}{n}$计算出6.2g氧化钠的物质的量,再根据氧化钠的化学式计算出含有钠离子的物质的量;
C.1NA个H2O分子的物质的量为1mol,含有1mol氧原子,不存在氧气分子;
D.标准状况下,乙醇的状态不是气体.
解答 解:A.4.4g二氧化碳的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,故A正确;
B.6.2g氧化钠的物质的量为:$\frac{6.2g}{62g/mol}$=0.1mol,0.1mol氧化钠中含有0.2mol钠离子,故B错误;
C.1NA个H2O分子的物质的量为1mol,1mol水分子中含有1mol氧原子,不含有氧分子,故C错误;
D.标准状况下,乙醇不是气体,不能使用标准状况下的气体摩尔体积计算22.4L乙醇的物质的量,故D错误;
故选A.
点评 本题考查了有关物质的量的简单计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数等之间的关系为解答关键,D为易错点,注意明确标准状况下气体摩尔体积的使用条件.


科目:高中化学 来源: 题型:解答题
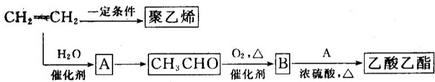
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 | B. | 0.16mol•L-1 | C. | 0.32mol•L-1 | D. | 0.08mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
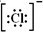 ;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.
;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳棒上放出氯气 | B. | 碳棒上放出氧气 | C. | 碳棒附近产生OH- | D. | 铁钉被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(H+)=c(OH-)+c(NH3•H2O) | ||
| C. | c(SO42-)+c(OH-)=c(NH4+)+c(Fe2+)+c(H+) | D. | c(NH3•H2O)+c(NH4+)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
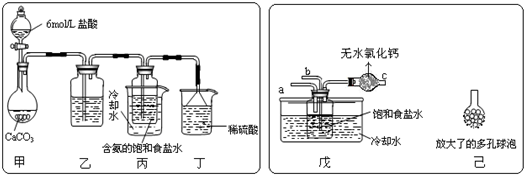
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
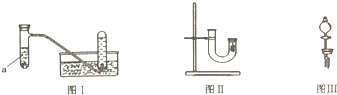
| 实验步骤 | 问题 |
| 1.从U型管左端加入稀硝酸直至充满U型管右端 | / |
| 2.用附有铜丝的胶塞塞住U型管右端,观察现象 | U型管右端产生无色气体,溶液变蓝色 |
| 3.待反应停止后打开胶塞,观察实验现象 | 现象是无色气体与空气接触后立即变成红棕色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com