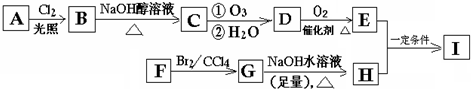
锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl
2?6H
2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO
4)为原料制备,生产流程如下:
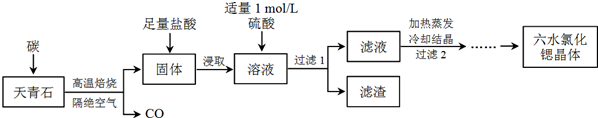
已知:①经盐酸浸取后,溶液中除含有Sr
2+和Cl
-外,还含有少量Ba
2+杂质;
②SrSO
4、BaSO
4的溶度积常数分别为3.3×10
-7、1.1×10
-10;
③SrCl
2?6H
2O的摩尔质量为:267g/mol.
(1)天青石焙烧前先研磨粉碎,其目的是
.
(2)隔绝空气高温焙烧,若0.5mol SrSO
4中只有S被还原,转移了4mol电子.写出该反应的化学方程式:
.
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是
.
(4)加入硫酸的目的是
.为了提高原料的利用率,滤液中Sr
2+的浓度应不高于
mol/L(注:此时滤液中Ba
2+浓度为1×10
-5 mol/L).
(5)产品纯度检测:称取1.000g产品溶解于适量水中,向其中加入含AgNO
3 1.100×10
-2mol的AgNO
3溶液(溶液中除Cl
-外,不含其它与Ag
+反应的离子),待Cl
-完全沉淀后,用含Fe
3+的溶液作指示剂,用0.2000mol/L的NH
4SCN标准溶液滴定剩余的AgNO
3,使剩余的Ag
+以AgSCN白色沉淀的形式析出.
①滴定反应达到终点的现象是
.
②若滴定过程用去上述浓度的NH
4SCN溶液20.00mL,则产品中SrCl
2?6H
2O的质量百分含量为
(保留4位有效数字).




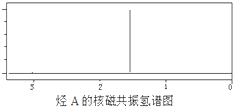 某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:
某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应: