
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
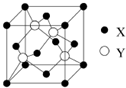
(1)X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。若其晶胞边长为540.0pm,则密度为 ,X与最近的Y之间的距离为
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(1)①4 ②ZnS ;4.1g/cm3; (2)sp3
(2)sp3
(3)①正四面体 ②CCl4或SiCl4等 (4)16NA或16×6. 02×1023个
【解析】
试题分析:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,所以X是Zn。元素Y基态原子的3p 轨道上有4个电子,则Y应该是S元素。元素Z 的原子最外层电子数是其内层的3倍,则Z是氧元素。
(1)①根据晶胞结构冰依据均摊法可知,在1个晶胞中,X离子的数目为 个。
个。
②同样计算可知,含有Y的数目也4个,所以该化合物的化学式为ZnS。根据晶胞的结构可知,若其晶胞边长为540.0pm,则密度=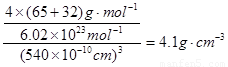 。根据晶胞的结构可知,S原子周围的4个锌原子构成正四面体型结构,则X与最近的Y之间的距离为
。根据晶胞的结构可知,S原子周围的4个锌原子构成正四面体型结构,则X与最近的Y之间的距离为 或
或 或
或 。
。
(2)H2S是V形结构,则S原子是sp3杂化。
(3)①在SO42-中中心原子S原子含有的孤对电子对数=(6+2-4×2)÷2=0,所以YZ42-的空间构型为正四面体。
②原子数和价电子数分别都相等的是等电子体,则和SO42-互为等电子体的可以是CCl4或SiCl4等。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,由于1个氨气分子中含有3个σ键,另外又形成形成4个配位健,则含有的σ键数目是3×4+4=16,所以1mol该配合物中含有σ键的数目为16NA或16×6. 02×1023个
考点:考查核外电子排布式、共价键、等电子体、分子空间构型以及晶体类型的有关计算和判断
点评:该题是中等难度试题的考查,也是高考中的常见题型。试题综合性强,贴近高考,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力以及空间的想象能力。有助于提升学生的学科素养,提高学生的应试能力。该题的难点是晶体的有关计算,所以熟练掌握好均摊法。


科目:高中化学 来源: 题型:
 (2013?江苏)A.[物质结构与性质]
(2013?江苏)A.[物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。

(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省师大附中高二下学期期末考试化学试卷(带解析) 题型:填空题
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。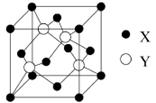
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试化学(江苏卷解析版) 题型:填空题
[物质结构与性质]
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com