
【题目】为合理利用“垃圾”资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐等可以归为一类加以回收,它们属于
A. 有机物 B. 无机盐 C. 金属或合金 D. 难溶性碱
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】1个硫原子的质童是a g,l个l2C原子的质童是bg,用NA表示阿伏加德罗常数的值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ;
;
②m g该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNAg
④a g该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
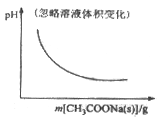
【题目】各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A. CH3OCH3(g)+3H2O(g) ![]() 6H2(g) + 2CO2(g): △H>0
6H2(g) + 2CO2(g): △H>0

B. CH3COOH![]() H++CH3COO-
H++CH3COO-
C. FeCl3+3KSCN![]() Fe(SCN)3+3KCl
Fe(SCN)3+3KCl

D. N2(g) +3H2(g)![]() 2NH3(g)
2NH3(g)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

己知:
I.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式;
II. CeO2不溶于稀硫酸;利用有机溶剂可分离稀土元素如Ce等化合物。
请按要求回答下列问题:
(1)Ce的原子序数为58,它位于元素周期表中第______周期。
(2)步骤①、⑥反应的化学方程式分别为_________________、______________。
(3)检验滤渣B洗涤干净的方法是____________________。
(4)步骤③的离子方程式为____________________。
(5)操作X名称为_________________。
(6)在滤液B中加过量铁粉于50 °C水浴中加热充分反应后趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集得产品绿矾。
步骤②中的硫酸溶液过稀会导致____________;静置冷却一段时间后,在试管中观察到的现象是______________________。
(7)取2.08 g产品Ce(OH)4加过量稀硫酸溶解后,用0.1000 mol/L FeSO4溶液滴定至终点共消耗90.00mL,则产品中Ce(OH)4的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新合成的一种烃,其碳骨架呈三棱柱体(如图所示,碳碳键键长相等)。

(1)写出该烃的分子式__________。
(2)该烃的一氯代物是否有同分异构体_______________ 。
(3)该烃的四氯代物有多少种同分异构体____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
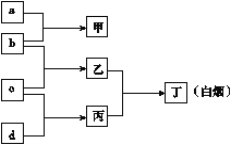
【题目】短周期元素R、X、Y、Z的原子序数依次增大, a、b、c、d是这4种元素的单质(a、b、c、d顺序不与R、X、Y、Z对应),a为生活中常见的金属,厨房中常见a金属合金餐具和器具。在甲的溶液中通入丙气体,产生白色沉淀,它们之间转化关系如图所示。
回答下列问题:
(1)写出Z元素在元素周期表中的位置______________________;
(2)写出物质丙的电子式__________________;
(3)X、Y、Z元素简单离子的半径由大到小排列的顺序为(用离子符号表示)______________;
(4)写出Y元素的氢氧化物与NaOH溶液反应的离子方程式______________________________;
(5)As(砷)与X是同族元素,位于第四周期,请写出砷原子的原子结构示意图____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu.Fe三种金属元素组成,回答下列问题:
(1)①铜元素位于周期表中_____区。Cu2+离子的价层轨道表示式为____。
②锰、铁、钴三种元素的逐级电离能如下表:
电离能/KJ/mol | I1 | I2 | I 3 | I4 |
Mn | 717.3 | 1509.0 | 3248 | 4940 |
Fe | 762.5 | 1561.9 | 2957 | 5290 |
Co | 760.4 | 1648 | 3232 | 4950 |
铁元素的第三电离能明显低于锰元素和钴元素,其原因是____。
③实验室可用赤血盐K3[Fe(CN)6]检验Fe2+离子,在赤血盐中铁元素的化合价为____,中心离子的配位数为______。
(2)利用反应:X+C2H2+NH3→Cu2C2+NH4Cl(未配平)可检验乙炔。
①化合物X晶胞结构如图,据此可知X的化学式为_______。

②乙炔分子中σ键与π键数目之比为______,碳原子的杂化方式为_______;NH4+空间构型为______(用文字描述)。
(3)①下列三种化合物a.AlCl3 b.NaCl c.Al2O3沸点由高到低依次是_______(填编号),其原因是____________。
②Al单质中原子采取面心立方最密堆积,其晶胞边长为0.405nm,列式表示Al单质的密度_______g/cm3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. S的摩尔质量是32g B. 1mol12C的质量是6g
C. 1molO2 的质量是32g/mol D. Fe2+摩尔质量是56g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com