

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |

分析 (1)配制硫酸溶液需要用到烧杯、量筒、玻璃棒、容量瓶以及胶头滴管等容器;
(2)加入的NaClO可与Mn2+反应生成MnO2,SiO2不反应,则滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有MnO2、SiO2,
(3)溶液经蒸发、浓缩、结晶、过滤后可得到晶体;
(4)溶液中含有Mn2+、Fe2+,具有还原性,可与NaClO发生氧化还原反应;
(5))[Al(OH)]2+与H+结合,可转化为[Al(OH)]+;
(6)向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,证明银做原电池负极,发生的反应为铁离子氧化为银;实验可知银离子具有强氧化性氧化亚铁离子为铁离子.
解答 解:(1)配制硫酸溶液需要用到烧杯、量筒、玻璃棒、100mL容量瓶以及胶头滴管等容器,
故答案为:烧杯、100mL容量瓶;
(2)加入的NaClO可与Mn2+反应生成MnO2,SiO2不反应,则滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有MnO2、SiO2,
故答案为:MnO2、SiO2;
(3)溶液经蒸发、浓缩、结晶、过滤后可得到晶体,故答案为:过滤(或过滤洗涤);
(4)溶液中含有Mn2+、Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(5)[Al(OH)]2+与H+结合,可转化为[Al(OH)]+,离子方程式为[Al(OH)]2++H+=[Al(OH)]++H2O,
故答案为:[Al(OH)]2++H+=[Al(OH)]++H2O;
(6)向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,依据电子流向可知乙池中银做原电池负极,发生的反应为铁离子氧化为银生成亚铁离子;由实验现象得出,Ag+和Fe2+反应生成铁离子和金属银,反应的离子方程式是Fe2++Ag+?Fe3++Ag;
故答案为:负;Fe2++Ag+?Fe3++Ag.
点评 本题考查物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,有一定难度,本题注意要认真分析题中数据,考查学生的分析能力.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:解答题
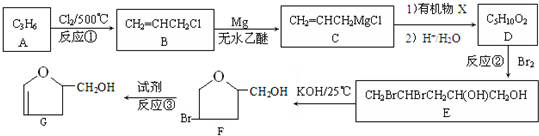
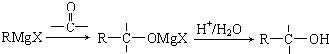
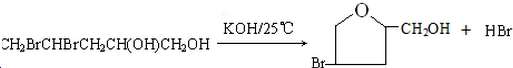 (或
(或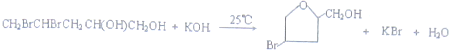 );;
);;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
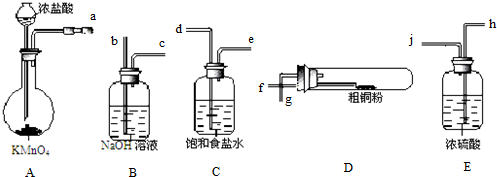

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 雾霾中含有大量的PM2.5,PM2.5又称为“细颗粒物”,它容易附着有毒有害物质,尤其是重金属,对人体造成危害 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
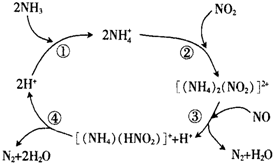 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性 | |
| D. | 铁粉与过量硫粉反应生成硫化亚铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com