
【题目】焦亚硫酸钠(Na2S2O5)可用作还原剂,印染媒染剂、食品防腐剂等。一种湿法制备焦亚酸钠的工艺流程如图。
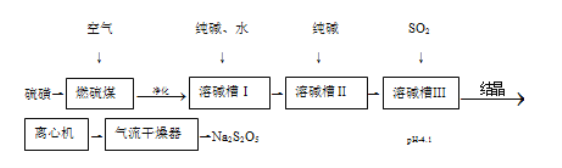
已知:过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5。
(1)硫磺先加热成液态后喷人燃硫炉中,作用是__。
(2)“净化”需要除去的杂质气体是__。
(3)溶碱槽Ⅰ中需要通入足量SO2,若SO2不足,则生成__。
(4)溶碱槽Ⅲ中反应的化学方程式为__。
(5)离心机分离后的母液需要返回到溶碱槽__循环使用(填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(6)气流干燥器中发生的化学方程式为__。
(7)为了测定所得产品中Na2S2O5的百分含量,取m克样品加水溶解,用cmol·L-1的碘标准液滴定到终点消耗碘标准液VmL.该产品中Na2S2O5的百分含量为__(用字母表示)。
【答案】增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率 氧气 Na2SO3 SO2+Na2SO3+H2O=2NaHSO3(或者2SO2+Na2CO3+H2O=2NaHSO3+CO2) Ⅰ 2NaHSO3=Na2S2O5+H2O ![]() %
%
【解析】
该原理为:硫磺燃烧生成SO2,净化后在溶碱槽Ⅰ中与碳酸钠反应生成NaHSO3与二氧化碳,NaHSO3在溶碱槽Ⅱ中与碳酸钠再反应生成Na2SO3,Na2SO3在溶碱槽Ⅲ中与SO2反应生成NaHSO3,过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5。
(1)硫磺燃烧前先加热成液态并通过喷嘴喷入焚硫炉中,增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;故答案为:增大硫与空气的接触面积,使硫磺充分燃烧,加快反应速率;
(2)由转化关系可知,反应中需要的是空气,故要除去多余的氧气,故答案为:氧气;
(3)SO2足量生成NaHSO3,若SO2不足,则生成Na2SO3,故答案为:Na2SO3;
(4)Na2SO3在溶碱槽Ⅲ中与SO2反应生成NaHSO3,若在溶碱槽Ⅱ中碳酸钠过量,那么碳酸钠在溶碱槽Ⅲ中也与SO2反应,故答案为:SO2+Na2SO3+H2O=2NaHSO3;(或者2SO2+Na2CO3+H2O=2NaHSO3+CO2);
(5)过饱和NaHSO3溶液经结晶、离心分离,故离心机分离后的母液为NaHSO3溶液,可和溶碱槽Ⅰ中与碳酸钠反应生成NaHSO3一起被用,故答案为:Ⅰ;
(6)过饱和NaHSO3溶液经结晶、离心分离、干燥制得Na2S2O5,反应为:2NaHSO3=Na2S2O5+H2O,故答案为:2NaHSO3=Na2S2O5+H2O;
(7)设产品中Na2S2O5的百分含量为ω,则利用化合价升降配平可知:2I2+S2O52-+3H2O=4I-+2SO42-+6H+,则有数量关系Na2S2O5~2I2,则n(Na2S2O5)= cmolL-1×VL×10-3×![]() =
=![]() Vc×10-3mol,所以产品的纯度为
Vc×10-3mol,所以产品的纯度为 =
=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年9月23日,中国科学家屠呦呦获得了美国拉斯克医学奖的临床医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。下图是青蒿素的结构,则有关青蒿素的说法中不正确的是:

A.青蒿素分子式为C15H22O5
B.青蒿素有—O—O—键具有较强的氧化性
C.青蒿素易溶于水、乙醇、苯
D.青蒿素在碱性条件下易发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向0.1molL-1CH3COOH 溶液中加入少量水,溶液中 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种基于锂元素的电化学过程来合成氨的方法,其效率能达到88.5%。其工艺流程如图所示,下列说法错误的是( )
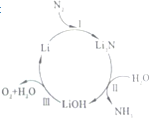
A.反应Ⅰ的关键是隔绝空气和水
B.反应Ⅱ的产物LiOH是离子化合物
C.整个流程中,金属锂是催化剂
D.整个流程的总化学方程式为:2N2+6H2O═4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2+2S2O32-=S4O62-+2I-;CuI是不溶于水的白色沉淀。
相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用文字叙述):____________________________________________。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用_______________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是重要的有机化工原料,Y是一种功能高分子材料,下面为各物质之间的转化关系(部分产物、合成路线、反应条件略去)。
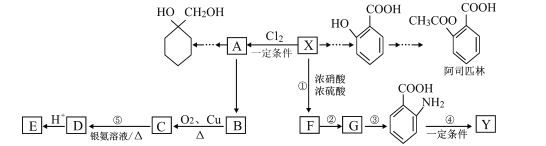
已知:①X为芳香烃,其相对分子质量为92;
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基![]() ;
;
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)E的分子式为___,反应②的反应类型是___。
(2)1mol阿司匹林最多能与___mol氢氧化钠溶液反应。
(3)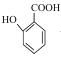 与少量碳酸氢钠反应的化学方程式___。
与少量碳酸氢钠反应的化学方程式___。
(4)反应④的化学方程式为___。
(5)比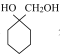 少一个碳原子的有机物(分子式为C6H12O2)有多种同分异构体,其中同时符合下列条件的有___种。
少一个碳原子的有机物(分子式为C6H12O2)有多种同分异构体,其中同时符合下列条件的有___种。
①能与金属钠反应 ②含两个甲基 ③能发生银镜反应;
其中核磁共振氢谱为6:2:2:1:1的有机物结构简式为___ (只写任意一种)。
(6)参照上述合成路线,结合所学知识,写出以A为原料制备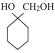 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为__,第二周期第一电离能比B高的元素有__种。
(2)B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__(标出配位键),其中心原子的VSEPR模型名称为__,写出[BH4]-的两种等电子体__。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为__(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有__。
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E、C的坐标分别为B(1,0,0)、E(0,1,0)、C(0,0,1),请写出D点的坐标:D:___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com