
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化等再利用。请回答:
(1)已知:①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol
②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol
③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol
④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol
反应③的a=______,反应④自发进行的条件是______(填“高温”、“低温”或“任意温度”)
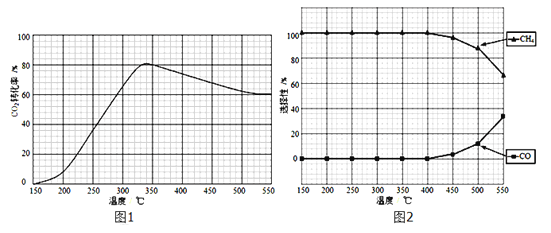
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量x mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应ⅠCO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g)![]() CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
①下列说法正确的是___________。
A.△H5 小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应I在t1时刻达到平衡,平衡时容器体积为yL,该温度下反应I的平衡常数为____(用x、y 表示)。
(3)CO2溶于水形成H2CO3。已知常温下H2CO3 的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.75×10-5。常温下,用氨水吸收CO2 可得到NH4HCO3 溶液,NH4HCO3 溶液显______(填“ 酸 性”、“ 中性” 或“ 碱性”);请计算反应NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3 的平衡常数K=_____________。
NH3·H2O+H2CO3 的平衡常数K=_____________。
(4)据文献报道,二氧化碳可以在酸性水溶液中用情性电极电解得到乙烯,其原理如图所示。
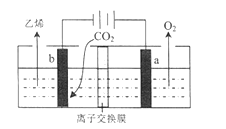
b电极上的电极反应式为____________________________,该装置中使用的是________(“ 阴”或“ 阳”) 离子交换膜。
【答案】 -318 高温 AB 625y2/x2 碱性 1.3×10-3 2CO2+12H++12e- ==== C2H4+4H2O 阳
【解析】(1). 已知①.2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351kJ/mol,②. 2C(s)+ O2(g)=2CO(g) △H2=-221kJ/mol,③. 2Al(g)+ N2(g)=2AlN(s) △H3=a kJ/mol,④. Al2O3(s)+ 3C(s)+ N2(g)=2AlN(s)+3CO(g) △H4=+1026kJ/mol,根据盖斯定律,(①+②×3+③×2)÷2=④,解得△H3=-318 kJ/mol;若△G=△H-T△S<0,则反应能自发进行,反应④的△H>0,△S>0,因此该反应能自发进行的条件为高温,故答案为:-318;高温;
(2).①. A. 根据图1可知,CO2的转化率先增大是因为反应正向进行,到一定温度时达到平衡,升高温度CO2的转化率减小,说明正反应为放热反应,△H5小于零,故A正确;B. 由图2可知,随温度升高甲烷的选择性降低,CO的选择性增加,因此温度可影响产物的选择性,故B正确;C. CO2转化率先增大是因为反应正向进行未达到平衡状态,达到平衡状态后,随温度升高CO2的转化率减小,故C错误;D. CO2和H2混和气体(体积比1:4,总物质的量x mol)进行反应,其他条件不变,将CO2和H2的初始体积比改变为1:3,相当于减小氢气的量,CO2平衡转化率减小,故D错误;答案为:AB;
②. 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为yL,二氧化碳的转化率为80%,根据三段式法有:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
起始量(mol) 0.2x 0.8x 0 0
转化量(mol) 0.16x 0.64x 0.16x 0.32x
平衡量(mol) 0.04x 0.16x 0.16x 0.32x
平衡常数K=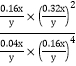 =625y2/x2,故答案为:625y2/x2;
=625y2/x2,故答案为:625y2/x2;
(3). 已知NH3·H2O的电离平衡常数Kb=1.75×105,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,Kb>K2,所以碳酸氢根离子的水解程度大于铵根离子的水解程度,NH4HCO3溶液显碱性;反应NH4++HCO3-+ H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=![]() =
= ![]() =1.3×10-3,故答案为:碱性;1.3×10-3;
=1.3×10-3,故答案为:碱性;1.3×10-3;
(4). 由图可知,电解时二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,因离子交换膜只允许氢离子通过,所以是阳离子交换膜,故答案为:2CO2+12H++12e-=C2H4+4H2O;阳。


科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B和C,下列判断中正确的是
2C(g)测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B和C,下列判断中正确的是
A. 平衡不移动
B. 平衡向逆反应方向移动
C. 新平衡时各物质的浓度都比原平衡时增大
D. C的质量分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应3A(g) ![]() 2B(g) +C(g)的下列叙述中,能说明反应已达到平衡的是( )
2B(g) +C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.C生成的速率与B分解的速率相等
B.单位时间内消耗3a mol A, 同时消耗生成a mol C
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+3B==2C+4D(A、B、C、D均为气态),在四种不同情况下的反应速率最快的是
A. v(A)=0.1mol/(L·s) B. v(B) =0.6mol/(L·s)
C. v(C) =0.6mol/(L·s) D. v(D) =0.8mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇可以发生下列化学反应,在反应里乙醇分子断裂碳氧键而失去羟基的是
A. 乙醇与金属钠反应 B. 乙醇与氢卤酸的取代反应
C. 乙醇的催化氧化反应 D. 乙醇和乙酸的酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
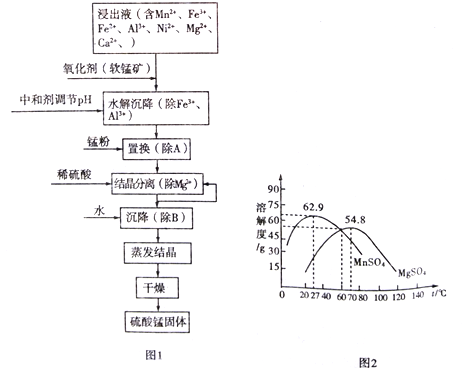
【题目】软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如下图图1所示。已知金属单质的活动顺序为Al>Mn>Fe>Ni。回答下列问题:
(1)用离子方程式表示加入“氧化剂(软锰矿)”作用:_________________________。
(2)已知:Ksp[Al(OH)3]=1.0×10-33 Ksp[Ni(OH)2]=1.6×10-15
Ksp[Mn(OH)2]=4.0×10-14 Ksp[Fe(OH)3]=2.6×10-39
“水解沉降”中:
①“中和剂”可以是__________(填标号)。
A.Al2O3 B.MgO C.H2SO4 D.MnO2
②溶液的pH应不低于______________。(离子浓度小于1×10-6mol/L时,即可认为该离子沉淀完全)
(3)“置换”的目的是____________________(用离子方程式表示)。
(4)“结晶分离”中的部分物质的溶解度曲线如上图图2所示。结晶与过滤过程中,体系温度均应维持在______________℃(填“27”、“60”或“70”)。
(5)“草酸钠一高锰酸钾返滴法”可测定软锰矿中MnO2的纯度(假设杂质不参与反应):取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1 mol/LNa2C2O4溶液(足量),最后用c2mol/L的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为________________________。
②该样品中MnO2的质量分数为______(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加人Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态银原子的最外层电子排布式为 _______。
(2)Na、O、S简单离子半径由大到小的顺序为______________________。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为_______________________。

(4)写出AgBr 溶于Na2S2O3溶液的离子反应方程式______________。Na3[Ag(S2O3)2]中存在的作用力有离子键、共价键、______________。
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2 分子中硫原子的价层电子对数为_________,其分子空间构型为______________。 SO2易溶于水,原因是________________________________。
(6)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图象的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol -1,试通过这些数据列出计算阿伏加德罗常数的算式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下列实验装置探究SO2的性质。
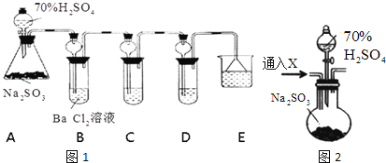
根据要求回答下列问题:
(1)装置A中反应的化学方程式为__________________________________________。
(2)利用装置C可以证明SO2具有漂白性,C中盛放的溶液是__________________。
(3)通过观察D中现象,即可证明SO2具有氧化性,D中盛放的溶液可以是________。
A.NaCl溶液 B.酸性KMnO4 C.FeCl3 D.Na2S溶液
(4)研究小组发现B中有白色沉淀BaSO4生成,为进一步验证B中产生沉淀的原因,研究小组进行如下两次实验:
实验i:另取BaCl2溶液,加热煮沸,冷却后加入少量苯(起液封作用),然后再按照上述装置进行实验,结果发现B中沉淀量减少,但仍有轻微浑浊.
实验ii:用如上图2的F装置代替上述实验中的A装置(其他装置不变),连接后往装置F中通入气体X一段时间,再加入70%H2SO4溶液,结果B中没有出现浑浊.
①“实验i”中煮沸BaCl2溶液的目的是_______________________;
②气体X可以是____________(填序号)。
A.CO2 B.C12 C.N2 D.NO2
③B中形成沉淀的原因是(用化学方程式表示):________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 分子式符合C5H11Cl的化合物有6种
C. 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3
D. 菲的结构简式为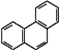 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com