
����˵����ȷ����( )
�ٿ���Ba(OH)2��Һͬʱ����AgNO3��AlCl3��NH4Cl��NaCl��Na2SO4������Һ
�����ǡ����ᱵ��ˮ�ֱ����ڷǵ���ʡ�ǿ����ʺ��������
����Ϊ�����ԣ�HClO>H2SO4�����Էǽ����ԣ�Cl>S
�ܽ���ı��������Ƕ��������
�ݳ�ȥ�����л��е��������ۣ��ɼ������������������Һ����ȫ��Ӧ�����
A���٢ڢ� B���٢ڢ� C���ڢܢ� D��ȫ��
 �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�ʽ�У�������ȷ�����뷽��ʽ����w.w.w.k.s.5 u.c.o.m
A��HCO3- + H2O  H2CO3 + OH- B��CH3COONa
H2CO3 + OH- B��CH3COONa CH3COO��+Na+
CH3COO��+Na+
 C�� Ca(OH)2 Ca2����2OH�� D��NH3·H2O
C�� Ca(OH)2 Ca2����2OH�� D��NH3·H2O  NH4+ + OH-
NH4+ + OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��ZΪ3�����壬��a mol X��b mol Y����һ�ܱ������У�������ӦX+2Y 2Z�ﵽƽ��ʱ�������ǵ����ʵ�������n(X)+n(Y)=n(Z)����Y��ת����Ϊ
2Z�ﵽƽ��ʱ�������ǵ����ʵ�������n(X)+n(Y)=n(Z)����Y��ת����Ϊ
A. ��100% B.
��100% B. ��100%
��100%
C. ��100% D.
��100% D. ��100%
��100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������֪��448��ʱ����ӦH2��g��+I2��g�� 2HI��g����ƽ�ⳣ��K1Ϊ49������¶��� ��Ӧ
2HI��g����ƽ�ⳣ��K1Ϊ49������¶��� ��Ӧ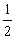 H2��g��+
H2��g��+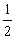 I2��g��
I2��g�� HI��g����ƽ�ⳣ��K2Ϊ__________��
HI��g����ƽ�ⳣ��K2Ϊ__________��
������һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g�� CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
| t/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1)�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=____________________��
��2)�÷�ӦΪ__________��Ӧ������ȡ����ȡ�����
(3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������ǣ� ����
A.������ѹǿ���� B.���������C��CO������
C.V(H2)��=V(H2O)�� D. c��CO2����c��CO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijУ�С��Ϊ̽��������ʴ�����ԭ�������������ͼa��ʾװ�ã�ͼa������ĩ�ηֱ�����һ��ZnƬ��CuƬ���������ں���K3Fe(CN)6����̪�Ļ�������ϡ�һ��ʱ�����������ijЩ��������ͼbʾ�������˱仯����֪Fe2+����K3Fe(CN)6�����飨����ɫ����������˵������ȷ���ǣ� ��
A���������ֺ�ɫ B����������Zn2+
C�����������ĵ缫��Ӧʽ��Cu-2e-= Cu2+ D������������ɫ


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����£�Ka(HF)=6.8��10-4mol��L-1,Ka(CH3COOH)=1.7��10-5 mol��L-1���������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L��NaF��CH3COONa�����Һ������˵����ȷ����( )
A��c(OH-)��c(HF)��c(CH3COOH)��c(H+) B��c(OH-)��c(F-)��c(CH3COO-)��c(H+)
C��c(F-)+ c(CH3COO-)=2 c(Na+) D��c(HF)+c(CH3COOH)+ c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ˮ��Һ�ֳ�Ϊ˫��ˮ��������������ɱ����Ư�ȡ�ij��ѧ��ȤС��ȡһ�����Ĺ���������Һ��ȷ�ⶨ�˹��������Ũ�ȣ� ����д���пհף�
(1)��10.00 mL����������Һ����250mL ___________(����������)�У���ˮϡ�����̶ȣ�ҡ�ȡ���ȡϡ�ͺ�Ĺ���������Һ25.00mL����ƿ�У�����ϡ�����ữ��������ˮϡ�ͣ�������������
(2)�ø�����ر���Һ�ζ������������䷴Ӧ�����ӷ���ʽ���£��뽫������ʵĻ�ѧ�������ͻ�ѧʽ�ֱ��������к��ߺ������ڡ�
MnO4- + H2O2 + H+ ==== Mn2+ + H2O + ( )
(3)��ȡ10mL����������Һ������_______(���ʽ����ʽ��)�ζ��ܡ��ζ������յ��������___ _��
(4)�ظ��ζ����Σ�ƽ������c mol/L KMnO4����ҺV mL����ԭ����������Һ�й��������Ũ��Ϊ________��
(5)��ʢװ������ر���Һ�ĵζ���������ˮϴ��û���ñ�Һ��ϴ����ⶨ���______(�ƫ�ߡ���ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ�Ҹոշ�����ij��Ԫ�ص�ԭ�ӣ�1����ԭ��������a g��һ��12C��ԭ��������b g��NA�ǰ����ӵ�������ֵ������˵����ȷ���ǣ� ��
�ٸ�ԭ�ӵ����ԭ������Ϊ ��m g��ԭ�ӵ����ʵ���Ϊ mol
�۸�ԭ�ӵ�Ħ��������aNA g ��Wg��ԭ���к��� ����ԭ��
����ԭ��
������֪��Ϣ�ɵã�
A���٢ڢܡ�������B���ڢۢ� C���٢ڢ� D���٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ���ǣ� ��
A��95�洿ˮ��pH��7��˵�����ȿɵ���ˮ������
B��pH = 3�Ĵ�����Һ��ϡ����10����pH = 4
C��0.2 mol��L��1�����ᣬ������ˮ��Ϻ�pH = 1
D��pH = 3�Ĵ�����Һ����pH = 11������������Һ�������Ϻ�pH = 7
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com