
| V |
| Vm |
| n |
| V |
| ||
| 0.2L |
| 0.3L×0.5mol/L |
| 1.5mol/L |


科目:高中化学 来源: 题型:
| 元素 | 有关性质或结构信息 |
| X | 基态原子的最外层电子排布式为nsnnpn |
| Y | 双原子分子单质在标准状况下密度为1.429g/L |
| Z | 所在周期的单核离子中半径最小 |
| W | 该元素原子有1个未成对的p电子 |
| T | 其单质和合金常用于航天工业和航海工业,其单质被誉为“21世纪金属”,其核外电子排布次外层电子数是最外层电子数的5倍 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
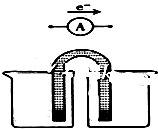 用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、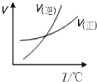 表示的反应速率随温度变化的关系可知该反应的△H>0 |
B、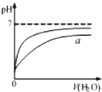 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
C、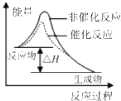 表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
D、 中开关K置于a或b处均可减缓铁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 180℃ |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应没有达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图1,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=+234kJ/mol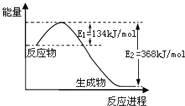 | ||||||||
B、一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| ||||||||
| C、已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液浓度为 5.6×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为 5×10-5 mol/L | ||||||||
D、在不同条件下进行的异构化反应 X?Y 的进程图解如下.图2中的“ ”是X,“ ”是X,“ ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小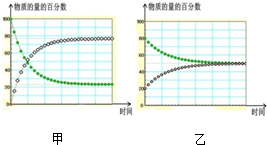 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com