
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
 .化合物丁存在的化学键类型是离子键、非极性共价键.
.化合物丁存在的化学键类型是离子键、非极性共价键. .
. 分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B原子最外层电子数比其次外层电子数多2,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和,A与B不可能处于同周期,则A为H元素;A与D同主族,结合原子序数可知D为Na;F原子序数最大,处于第三周期,F元素是同周期元素中原子半径最小的主族元素,则F为Cl;B、C同周期,由甲、乙的化学组成,可知C为O;C与E同主族,则E为S,故甲为H2O,乙为H2O2,丙为C2H2,丁为Na2O2,戊为H2S,己为NaCl,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B原子最外层电子数比其次外层电子数多2,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和,A与B不可能处于同周期,则A为H元素;A与D同主族,结合原子序数可知D为Na;F原子序数最大,处于第三周期,F元素是同周期元素中原子半径最小的主族元素,则F为Cl;B、C同周期,由甲、乙的化学组成,可知C为O;C与E同主族,则E为S,故甲为H2O,乙为H2O2,丙为C2H2,丁为Na2O2,戊为H2S,己为NaCl.
(1)B为C元素,化合物丙为C2H2,它的电子式为 ,化合物丁为Na2O2,存在的化学键类型是:离子键、非极性共价键,
,化合物丁为Na2O2,存在的化学键类型是:离子键、非极性共价键,
故答案为:C; ;离子键、非极性共价键;
;离子键、非极性共价键;
(2)化合物甲为水,戊为硫化氢,由于水分子间存在氢键而H2S分子中不存在氢键,所以水的沸点比硫化氢高;
同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>C>O,
故答案为:高;Na>C>O;
(3)发生反应:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,反应中一半O元素化合价由-1价升高为0价,另一半降低为-2价,0.2mol双氧水反应发生转移的电子为0.2mol,转移电子数目为0.2NA,
故答案为:0.2;
(4)氢气、氧气、KOH溶液组成燃料电池,正极发生还原反应,氧气在正极获得电子,碱性生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,本质是氢气燃烧生成水,NaOH的物质的量不变,
故答案为:O2+2H2O+4e-=4OH-;不变;
(5)NaCl由钠离子与氯离子构成,用电子式表示形成过程为 ,
,
故答案为: .
.
点评 本题考查元素化合物推断、元素周期律、电子式、氧化还原反应、原电池等,题目难度中等,推断元素是解题的关键,注意基础知识的全面掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
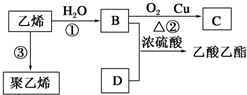
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH(CH3)OH | B. | CH3(CH2)3CH2OH | C. | CH3CH2C(CH3)2OH | D. | (CH3CH2)2CHOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
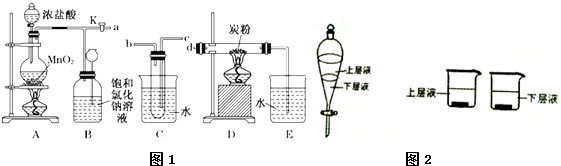
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石晶胞(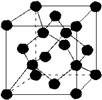 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8 | |
| B. | 二氧化硅晶体中最小环上的氧原子数、氯化铯晶体中氯离子的配位数均为6 | |
| C. | 锌晶胞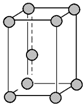 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12 | |
| D. | 33g CH≡C-CH=CH-CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
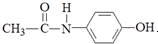 ,有关它的性质描述错误的是( )
,有关它的性质描述错误的是( )| A. | 它能与NaOH溶液反应 | |
| B. | 其水解产物之一对氨基苯酚(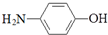 )具有弱酸性、弱碱性和强还原性 )具有弱酸性、弱碱性和强还原性 | |
| C. | 与对硝基乙苯互为同分异构体 | |
| D. | 1mol该物质与浓溴水反应时最多消耗Br23mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com