
【题目】下列说法正确的是( )
A.硫元素的同素异形体的性质相同
B.H2O2常做氧化剂,只有氧化性
C.向CaCl2溶液中通入CO2气体,有白色沉淀生成
D.汽车尾气中的NO主要是氮气和氧气在汽车汽缸中形成的
科目:高中化学 来源: 题型:
【题目】城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式___________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2 220.0 kJmol1。已知CO气体燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJmol1。试比较相同物质的量的C3H8和CO燃烧,产生的热量比值约为_________。
(3)已知氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol1。试比较同质量的氢气和丙烷燃烧,产生的热量比值约为______。
(4)氢气是未来的能源,除产生的热量大之外,还具有的优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
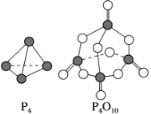
根据图示的分子结构和有关数据估算该反应的ΔH为________________。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)===1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
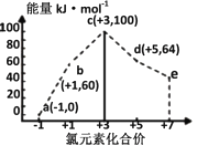
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( )
A.Fe3+、OH-、CO32-B.Mg2+、Cl-、Ba2+
C.NH4+、OH-、Al3+D.Fe2+、 NO3-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图是全钒液流电池的示意图
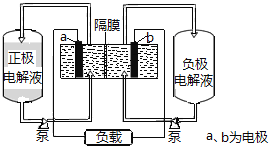
该电池充放电的总反应式为:
![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。
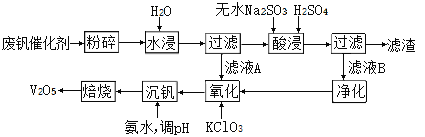
(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;上述过滤操作过程中所需用到的玻璃仪器有__________________________________。
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com