
分析 I.负极发生氧化反应,电极反应式为Zn+2OH--2e-═Zn(OH)2,总反应式减去负极反应式可得正极反应式;
Ⅱ.(1)根据化合价规则判断锰元素的化合价;
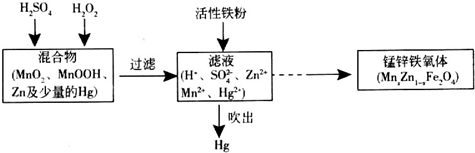
(2)由流程可知活性铁粉除汞时,Hg2+被还原为Hg;
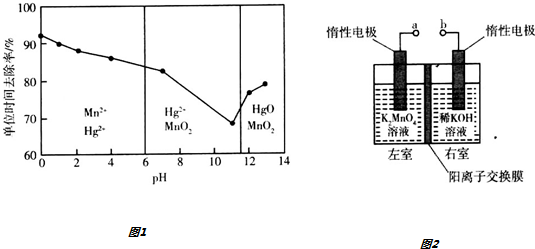
(3)①根据题给图象知pH=2时KMnO4溶液吸收汞蒸气生成Mn2+和Hg2+;
②不考虑酸性条件下氧化性增强因素,酸性条件下有Mn2+生成,可能是Mn2+具有催化作用;
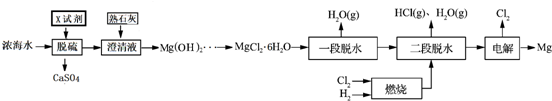
(4)①左室K2MnO4发生氧化反应生成KMnO4,故左侧电极为电解池的阳极;
②电解过程中阳极反应为MnO42--e-═MnO4-,阴极反应为2H2O+2e-═H2↑+2OH-,根据右室pH变化计算生成OH-的物质的量为0.1mol,再结合电子转移守恒计算.
解答 解:I.碱性锌锰干电池的总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,原电池中负极发生氧化反应,负极材料是Zn,电极反应式为:Zn+2OH--2e-═Zn(OH)2,总反应式减去负极反应式可得正极反应式,则正极反应式为:MnO2+H2O+e-═MnOOH+OH-,
故答案为:Zn;MnO2+H2O+e-═MnOOH+OH-;
Ⅱ.(1)MnxZn1-xFe2O4中铁元素化合价为+3,根据化合价代数和为0,可知锰元素的化合价为+2价,
故答案为:+2;
(2)由流程知活性铁粉除汞时,Hg2+被还原为Hg,铁粉的作用是还原剂,
故答案为:还原剂;
(3)①根据题给图象知pH=2时KMnO4溶液吸收汞蒸气生成Mn2+和Hg2+,反应的离子方程式为:5Hg+2MnO4-+16H+═2Mn2++5Hg2++8H2O,
故答案为:5Hg+2MnO4-+16H+═2Mn2++5Hg2++8H2O;
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是生成的Mn2+对反应起催化作用,单位时间内去除率高,
故答案为:Mn2+对反应起催化作用,单位时间内去除率高;
(4)①左室K2MnO4发生氧化反应生成KMnO4,故左侧电极为电解池的阳极,a应接直流电源的正极,
故答案为:正;
②电解过程中阳极反应为MnO42--e-═MnO4-,阴极反应为2H2O+2e-═H2↑+2OH-,已知25℃,两室溶液的体积均为100mL,电解一段时间后,右室溶液的pH由10变为14,电解后氢氧根离子浓度为1mol/L,则生成OH-的物质的量约是为0.1L×1mol/L=0.1mol,由电子转移守恒可知,理论上可制得0.1mol KMnO4,
故答案为:0.1mol.
点评 本题考查化学工艺流程、读图获取信息能力、电化学等,侧重考查学生对知识的迁移运用,难度中等.


科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
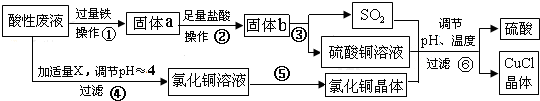
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{125a}{288V}$mol•L-1 | B. | $\frac{125a}{72V}$mol•L-1 | ||
| C. | $\frac{a}{2304V}$mol•L-1 | D. | 以上答案均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
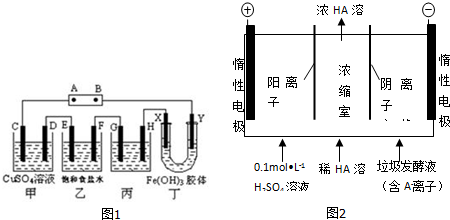
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
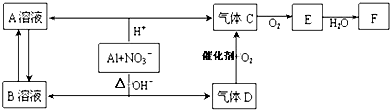
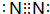
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com