
分析 化学式是CxHy,其式量是10y+6,则有12x+y=10y+6,燃烧的方程式为CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,结合反应的方程式计算.
解答 解:燃烧的方程式为CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,完全燃烧26.5g该烃,标准状况下生成44.8LC02,则
CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,
1 x
$\frac{26.5}{12x+y}$ $\frac{44.8}{22.4}$
则5x=4y,
又化学式是CxHy,其式量是10y+6,则有12x+y=10y+6,即4x=3y+2,
二者联式可得x=8,y=10,
则分子式为C8H10,
故答案为:C8H10.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,可以利用烃的组成通式列方程组计算,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
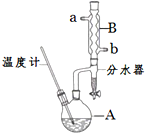 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | KMnO4 | C. | FeCl3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属族的族序数 | |
| B. | 在周期表里,主族元素所在的族序数等于原子核外电子数 | |
| C. | 副族元素没有非金属元素 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com