
下列有关叙述正确的是
A. O和 O和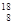 O中子数相同,质子数不同,互为同位素 O中子数相同,质子数不同,互为同位素 |
| B.H2O比H2S稳定,H-S键比H-O键更难断裂 |
| C.Na2O晶体中存在离子键,是离子化合物 |
| D.Na2O2晶体中阳离子与阴离子个数比为1:1 |
C
解析试题分析:A、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以 O和
O和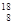 O质子数相同,中子数不同,互为同位素,A不正确;B、非金属性越强,氢化物的稳定性越强,所以H2O比H2S稳定,H-S键比H-O键更易断裂,B不正确;C、活泼的金属与活泼的非金属容易形成离子键,因此Na和O形成的是离子键。含有离子键的化合物是离子化合物,所以Na2O晶体中存在离子键,是离子化合物,C正确;D、Na2O2晶体中阳离子与阴离子分别是Na+、O2-,其个数比为2:1,D不正确,答案选C。
O质子数相同,中子数不同,互为同位素,A不正确;B、非金属性越强,氢化物的稳定性越强,所以H2O比H2S稳定,H-S键比H-O键更易断裂,B不正确;C、活泼的金属与活泼的非金属容易形成离子键,因此Na和O形成的是离子键。含有离子键的化合物是离子化合物,所以Na2O晶体中存在离子键,是离子化合物,C正确;D、Na2O2晶体中阳离子与阴离子分别是Na+、O2-,其个数比为2:1,D不正确,答案选C。
考点:考查同位素、原子组成、氢化物稳定性、离子键、离子化合物以及晶体结构的判断


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:单选题
“嫦娥三号”,携带的“玉兔号”月球车使用的耐压外壳为钛合金。某种超高硬度钛合金的成分为Ti—6.5A1—6V一4Cr—0.5Si,该钛合金中硅元素在周期表中的位置为
| A.第三周期ⅣA族 | B.第三周期ⅢA族 |
| C.第四周期ⅣA族 | D.第四周期ⅣB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z三种短周期元素在周期表中的位置如图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是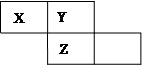
| A.气态氢化物的沸点:Z<Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.三种元素原子半径的大小顺序为: X>Y>Z |
| D.Z单质与Fe反应生成的化合物中,铁元素显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,Y与M形成的气态化合物在标况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.由X、Y、Z、M四种元素形成的化合物一定有共价键 |
| B.原子半径:W>Z>Y>X>M |
| C.由X元素形成的单质一定是原子晶体 |
| D.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法错误的是
| A.同主族元素的简单阴离子还原性越强,水解程度越大 |
| B.Na和Cs属于IA族元素,Cs失电子的能力比Na强 |
| C.IA族与VIIA族元素间可形成共价化合物或离子化合物 |
| D.同周期元素(0族元素除外)从左到右,原子半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
长式周期表共有18个纵行,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是
| A.第9列元素中有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第8列元素是铁元素 |
| D.第15列元素原子的最外层电子排布为ns2np5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/L X和W形成化合物的水溶液pH为1。下列说法正确的是( )
| A.由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 |
| B.RY2能与Y、Z形成的一种化合物反应生成Y2 |
| C.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
| D.Y和其他四种元素均可形成至少两种的二元化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
基态原子的价电子构型3s23p3,下列关于它的描述正确的是
| A.该元素的电负性小于1.8 |
| B.3p能级上的3个电子能量相等,自旋状态相同 |
| C.它的氢化物分子中有四个键合电子 |
| D.该元素的价电子数是4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质。已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1 mol·L-1丁溶液的pH=13。下列说法中正确的是( )
A.元素B在周期表中的位置为第二周期第ⅥA族
B.元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B)
C.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
D.1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com