
| A. | 铸铁输油管道应埋在干燥致密不透气的土壤中 | |
| B. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| C. | 钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-=4OH- | |
| D. | 在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
分析 A.铸铁在干燥致密不透气的土壤中不能构成原电池;
B.镀锌铁和电解质溶液能构成原电池,锌比铁活泼,锌做负极,铁作正极被保护;
C.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应;
D.铝和氧气反应生成一层致密的氧化物薄膜而阻止铝进一步被腐蚀;
解答 解:A.铸铁中含有碳、铁,在干燥致密不透气的土壤中不含电解质溶液,所以碳、铁不能构成原电池,则能防止铁被腐蚀,故A正确;
B.镀锌铁和电解质溶液能构成原电池,锌易失电子而作负极,则铁作正极被保护,故B正确;
C.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,正极电极反应是2H2O+O2+4e-=4OH-,故C错误;
D.铝是亲氧元素,极易和空气中氧气反应生成一层致密的氧化铝薄膜,从而阻止铝进一步被腐蚀,故D正确;
故选C.
点评 本题考查了金属的腐蚀与防护、原电池和电解池的原理分析应用,注意作原电池正极或电解池阴极的金属被保护,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子量依次递增 | |
| C. | 元素原子核外电子排布呈周期性变化 | |
| D. | 元素的最高正化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)与c(NH3•H2O)之和始终保持不变 | |
| B. | 水的电离程度始终增大 | |
| C. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$始终减小 | |
| D. | 当加入CH3COOH的体积为10mL时,溶液pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有8个中子的碳原子:$\stackrel{8}{6}$ C | B. | 氯离子的结构示意图: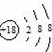 | ||
| C. | HCl的电子式: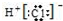 | D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q=9.2 kJ | B. | Q>9.2 kJ | C. | Q<9.2 kJ | D. | Q=18.4kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3→Al(OH)3 | B. | Al→Na[Al (OH)4] | C. | Fe→Fe(OH)2 | D. | SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ①③⑤ | C. | ②④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

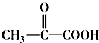 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$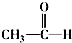 +CO2↑
+CO2↑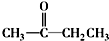 $→_{△}^{NaOHaq}$
$→_{△}^{NaOHaq}$ +H2O
+H2O .
.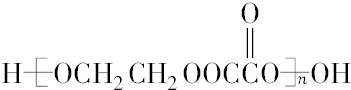 .
.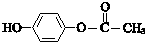 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com