
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
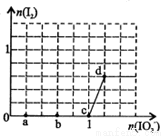
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
D
【解析】
试题分析:向NaHSO3的溶液中加入IO3-溶液,开始没有产生I2,在a点首先碘发生反应:6HSO3-+2IO3- = 6SO42-+2I-+6H+。在该反应中还原剂是NaHSO3,其中被氧化的元素是S元素,错误;B.由于在b点时n(IO3-)=0.6mol,反应消耗HSO3-的物质的量是1.8mol,发生的反应是:6HSO3-+2IO3- = 6SO42-+2I-+6H+。错误;C.c点到d点由于反应产生I2,所以发生的反应是:5I-+IO3- +6H+=3I2+3H2O,根据图像可知产生I2的物质的量是0.6mol。由于发生反应每转移5mol的电子,产生3mol的I2。现在产生0.6mol的I2,所以一共转移1mol电子,错误;D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,由于开始时KIO3过量,所以发生反应6HSO3-+2IO3- = 6SO42-+2I-+6H+产生的I-立即被氧化变为I2,因此开始时总反应的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O,正确。
考点:考查氧化还原反应中电子转移、反应的先后顺序及反应产物的判断的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:填空题
选做[物质结构与性质](10分)
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为______ <______<______ (填元素符号)。
<______<______ (填元素符号)。
(2)E元素基态原子的电子排布式为________________________________。
(3)XZ2的分子中含有 个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是____________ 。
(5)将YH3通入灼热EZ中发现黑色固体变红色,生成物对大气不造成污染。请写出有关化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:填空题
(14分)加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
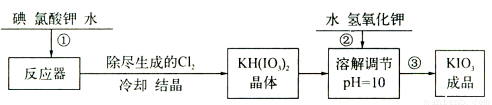
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为 、 。
②该实验可以用 作指示剂,滴定终点的现象是 。
③下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗
B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁
D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
有下列符号:35Cl和37Cl、O2和O3、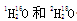 。下列有关说法正确的是
。下列有关说法正确的是
A.35和37表示的是质量数 B.35Cl和37Cl互称为同素异形体
C.O2和O3是氧元素的两种同位素 D.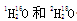 的相对分子质量相同
的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:实验题
(12分)亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组拟制备NaNO2并测定产品纯度。
I【查阅资料】
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性高锰酸钾氧化成NO2。
③酸性条件下MnO4-被还原为Mn2+。
Ⅱ【制备产品】
用如下装置制NaNO2(夹持和加热装置已省略)。
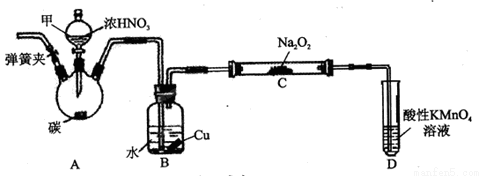
(1)装置A烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的作用是_________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是_________。(填字母编号)
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.生石灰
Ⅲ【测定纯度】.
设计如下方案测定产品的纯度。

(4)溶液A到溶液B发生反应的离子方程式为____________________________。
(5)取样品2.3g经一系列操作后得到溶液A100mL,准确量取10.00mL A与24.00mL 0.05mol/L的酸性KMnO4溶液在锥形瓶中充分反应。反应后溶液用0.1 mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(SO4)2溶液10.00ml,则样品中NaNO2的纯度为__________。
Ⅳ【探究反思】
(6)NaNO2的纯度偏低,该小组讨论提出的原因中可能正确的是________。(填字母编号)
A.滴定至溶液紫色刚好褪去就立刻停止滴加
B.加入A与KMnO4溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。X的最高价氧化物和气态氢化物的分子都是由极性键形成的非极性分子。下列性质比较中正确的是

A.最高价氧化物的水化物的酸性:Y<X<W
B.离子半径由小到大的顺序:W<Z<Y
C.单质晶体的熔点由低到高的顺序:Y<W<Z
D.原子最外层的电子数:Z<Y<X
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
下列过程没有发生化学反应的是
A.用氢氟酸来刻蚀玻璃器皿 B.用活性炭去除冰箱中的异味
C.用煤液化和气化得到清洁燃料 D.用热碱溶液清除炊具上残留的油污
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列有关常见金属和非金属及其化合物的说法正确的是
A.Na、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应
B.CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物
C.铝热反应是指铝能将所有的金属从其氧化物中置换出来
D.CaCO3+SiO2 CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:填空题
(16分)香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):
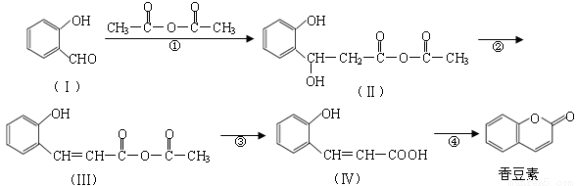
(1)Ⅰ的分子式为 ;1molⅠ与足量氧气完全燃烧消耗氧气的物质的量为 mol。
(2)物质Ⅳ中含氧官能团的名称 ,反应④的反应类型是 。
(3)香豆素在过量NaOH溶液中完全反应的化学方程式为 。
(4)Ⅴ是香豆素的同分异构体,写出符合下列条件的Ⅴ的结构简式
①苯环上只有两个处于对位的取代基②能使氯化铁溶液呈紫色 ③能发生银镜反应
(5)一定条件下,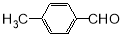 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com