
铝是一种低毒金属元素,它并非人体需要的微量元素,食用后不会导致急性中毒,但食品中铝的含量超过国家标准就会对人体造成危害。下列关于铝元素的说法正确的是( )
A.铝在空气中不易氧化是因为其性质不活泼
B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物
C.明矾可用于饮用水的杀菌消毒
D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.在饱和氯水中Cl-、NO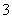 、Na+、SO
、Na+、SO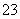 可以大量共存
可以大量共存
B.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
C.向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色说明原溶液中有I-
D.SO2通入碘水中,反应的离子方程式为SO2+I2+H2O===SO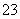 +2I-+2H+
+2I-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
工业炼铝的流程
铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因而可设计出两种提纯氧化铝的方案。
方案一:碱溶法
讨论回答下列问题:
(1)写出①、③两步骤中可能发生反应的离子方程式。
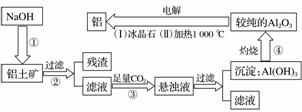
(2)步骤③中不用盐酸(或H2SO4)酸化的理由是__________________________。
(3)步骤④中得到较纯的Al2O3,可能含有________杂质,在电解时它不会影响铝的纯度的原因:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是( )
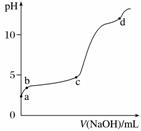
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH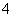 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO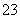 、SO
、SO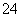 、NO
、NO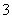 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH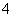 )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO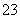 ,可能含有SO
,可能含有SO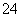 和NO
和NO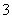
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色石蕊试纸变蓝的气体,该气体的化学式为____________________,说明固体中含有Mg3N2,生成该气体的化学方程式为________________________________________________________________________
________________________________________________________________________。
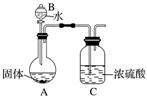
(2)乙组同学为测定Mg3N2的含量,用下图所示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是___________________________,对A加热的目的是_______________________。
已知加入的固体质量为4.0 g,最终C装置增重a g,则固体中含Mg3N2______ g(用含a的式子表示)。
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是_______________________。
有的同学认为乙组同学的测定结果偏低,理由是________________________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并灼烧固体至恒重,测得其质量为4.08 g。上述过程中,洗涤沉淀的操作是________________________________________________________________________
________________________________________________________________________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为______________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉混合煅烧时的化学反应方程式__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com