
某一密闭容器中充入NO2,在一定条件下进行反应:2NO2(g) 2NO(g)+O2(g)。达到平衡状态的标志是( )
2NO(g)+O2(g)。达到平衡状态的标志是( )
A. NO2的消耗速率与NO的生成速率相等
B. 容器内压强不随时间变化而变化
C. NO和O2的消耗速率之比为2∶1
D. 容器中各组分物质的浓度比为[NO2]:[NO]:[O2]=2:2:1
科目:高中化学 来源: 题型:
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.| A | B | C | D | |
| Ⅰ | 0.05mol?L-1 | a mol?L-1 | 0.05mol?L-1 | b mol |
| Ⅱ | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 | m mol |
| Ⅲ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 | n mol |
| Ⅳ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 | p mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?闵行区二模)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢课题.CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g),平衡时CO的转化率与温度、压强的关系如图:
(2012?闵行区二模)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢课题.CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g),平衡时CO的转化率与温度、压强的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
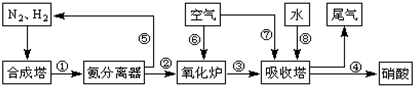
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| n(NO) |
| n(CO) |
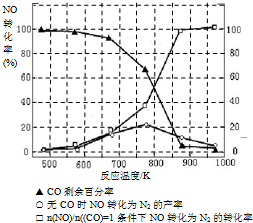
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省德阳市“一诊”考试化学试卷(解析版) 题型:填空题
一定温度时,在容积一定的密闭容器中,反应A(?)+B(g)  C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是 (填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是 。
(2)能判断该反应一定达到平衡状态的依据是 。(填写字母编号)
A.体积分数组成C%=D%
B.单位时间内生成n molA的同时生成n molC
C.温度和体积一定时,某一生成物浓度不再变化
D.温度和体积一定时,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如图所示。t2时改了某种条件,改变的条件是 。(填写字母编号)

A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省德阳市高三“一诊”考试化学试卷(解析版) 题型:填空题
(10分)一定温度时,在容积一定的密闭容器中,反应A(s)+B(g) C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是 (填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是 。
(2)能判断该反应一定达到平衡状态的依据是 。(填写字母编号)
A. 体积分数组成C%=D%
B. 单位时间内生成n moAl的同时生成n molC
C. 温度和体积一定是,某一生成物浓度不再变化
D. 温度和体积一定是,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如右图所示。

T2时改变了某种条件,改变的条件是 。(填写字母编号)
A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com