
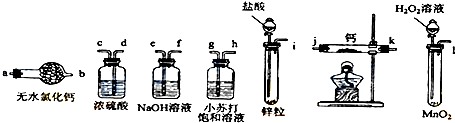
���� ��1��һ���Ʊ���������������ʵ��װ�õ�˳��Ϊ���Ʊ�װ�á�����װ�á�����װ�õȣ�
��2��ʵ�������Ҫ��֤����װ�����ѳ���������ʵ��IJ��������ǣ����װ�õ������ԡ������������ռ������������鴿�����ȷ�Ӧ��ֹͣ���ȡ�����ͨ��������ȴ��ֹͣͨ��������
��3��Ca��ˮ��Ӧ�ܲ���Ca��OH��2��H2����˲��ܸ������������ˮ�У�������ð������Һ�м����̪���Ժ�ɫ�����ж�ʵ����һ����CaH2���ɣ�
��4����Ϊ��Դ���⻯���ǹ��壬����������Я����ʹ��Ҳ�Ϸ��㣮
��� �⣺��1�������ڼ����õĽ�����������ˮ��Ӧ�����������ƺ����������Ʊ��������л����ˮ�������Ȼ��⣬��������ƻ���֮ǰ��Ҫ���Ӻ���ֱ�ѡ���Լ����������ƺ�Ũ���ͬʱΪ��ֹ������ˮ�������룬�����Ҫ���Ӹ���ܣ�������ȷ��˳��Ϊ��i��e��f��d��c��j��k����k��j����a��
�ʴ�Ϊ��i��e��f��d��c��j��k����k��j����a��
��2�����������ڼ�����������Ʒ�Ӧ������Ӧ�����ռ�һ�������岢�����䴿�ȣ���������ը��
�ʴ�Ϊ��B
��3��CaH2��Ca��ˮ��Ӧ���ܲ���Ca��OH��2��H2����Ӧ����ʽ�ֱ�Ϊ��CaH2+2H2O=Ca��OH��2+2H2����Ca+2H2O=Ca��OH��2+H2����
�ʴ�Ϊ����CaH2+2H2O=Ca��OH��2+2H2������Ca+2H2O=Ca��OH��2+H2����
��4����Ϊ��Դ���⻯�����Ա���������Я����ʹ��Ҳ�Ϸ��㣬
�ʴ�Ϊ���⻯���ǹ��壬Я�����㣮
���� ���⿼��Ԫ�ػ�����֪ʶ���漰�����ʵ����ʺ��Ʊ�ʵ�飬ע��ʵ���һ�㷽�������ע�ⰴ������������˳��Ϊ�״��㣬��Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢܢ� | B�� | �٢ڢۢ� | C�� | �ۢܢݢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
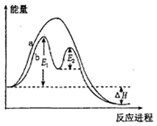
| A�� | ��Ӧ����a�д������� | |
| B�� | �÷�ӦΪ���ȷ�Ӧ | |
| C�� | �ı�������ɸı�÷�Ӧ�Ļ�� | |
| D�� | �д��������£���Ӧ�Ļ�ܵ���E1+E2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����淴Ӧ�����ʾ�Ϊ�� | B�� | �����淴Ӧ�����ڽ��� | ||
| C�� | �����淴Ӧ��������� | D�� | ��Ӧֹͣ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
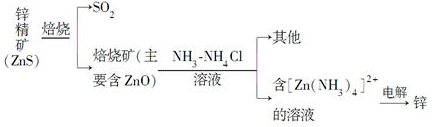
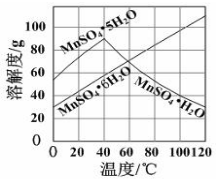
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com