
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.分析 由元素在周期表的位置可知,①~⑩分别为Na、K、Mg、Ca、Al、C、N、Cl、Br、Ar,
(1)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(2)①~⑩中元素最高价氧化物对应的水化物中,高氯酸的酸性最强;①和⑤的最高价氧化物的水化物反应生成偏铝酸钠和水;
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M为硝酸铵;
(4)元素③与⑧形成化合物为氯化镁,为离子化合物;
(5)Al为活泼金属,电解氧化铝冶炼Al.
解答 解:由元素在周期表的位置可知,①~⑩分别为Na、K、Mg、Ca、Al、C、N、Cl、Br、Ar,
(1)电子层越多,原子半径越大;同周期从左向右原子半径减小,则③~⑦元素中,原子半径最大的是Ca,故答案为:Ca;
(2)①~⑩中元素最高价氧化物对应的水化物中,高氯酸的酸性最强,其化学式为HClO4;①和⑤的最高价氧化物的水化物反应生成偏铝酸钠和水,离子反应为OH-+Al(OH)3=AlO2-+2H2O,
故答案为:HClO4;OH-+Al(OH)3=AlO2-+2H2O;
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M为硝酸铵,含离子键、(极性)共价键,故答案为:离子键、(极性)共价键;
(4)元素③与⑧形成化合物为氯化镁,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(5)Al为活泼金属,工业冶炼⑤的化学方程式为2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律及元素化合物知识的综合应用,题目难度不大.


 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液(KSCN) | B. | KOH(盐酸) | ||
| C. | Na2SO3溶液(BaCl2) | D. | HCHO溶液(石蕊试液) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
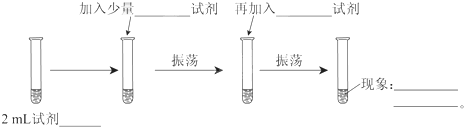
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.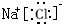
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
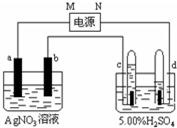 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.试管充满水,通电一段时间后,在c、d两极上共收集到标准状态下336mL气体,体积如图所示.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.试管充满水,通电一段时间后,在c、d两极上共收集到标准状态下336mL气体,体积如图所示.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2 Fe2+ | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com