
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
| A. | 反应在 t1min 内的平均反应速率为υ(CO2)=0.40/t1mol/(L•min) | |
| B. | 到 t1min 时,反应未达到平衡状态 | |
| C. | 温度升至 800℃时,上述反应的平衡常数为 0.64,则正反应为放热反应 | |
| D. | 保持 700℃不变,向平衡体系中再通入 0.60 mol CO 和 0.30 mol H2O,达到新的平衡,与原平衡相比,CO的转化率增大,H2的体积分数增大 |
分析 由表格中数据可知,
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1.2 0.6 0 0
t1时转化 0.4 0.4 0.4 0.4
t2时 0.8 0.2 0.4 0.4
A.结合v=$\frac{△c}{△t}$计算;
B.t1min与t2min时CO的物质的量相同;
C.K=$\frac{0.2×0.2}{0.4×0.1}$=1,温度升至 800℃时,上述反应的平衡常数为 0.64,可知升高温度,平衡逆向移动;
D.保持 700℃不变,向平衡体系中再通入 0.60 mol CO 和 0.30 mol H2O,Qc=$\frac{0.2×0.2}{0.7×0.25}$=0.23<K,平衡正向移动,设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1.4 0.5 0.4 0.4
转化 x x x x
平衡 1.4-x 0.5-x 0.4+x 0.4+x
K不变,可知(1.4-x)(0.5-x)=(0.4+x)(0.4+x),解得x=0.2mol,以此来解答.
解答 解:由表格中数据可知,
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1.2 0.6 0 0
t1时转化 0.4 0.4 0.4 0.4
t2时 0.8 0.2 0.4 0.4
A.反应在 t1min 内的平均反应速率为υ(CO2)=$\frac{\frac{0.4mol}{2L}}{{t}_{1}min}$=$\frac{0.2}{{t}_{1}}$mol/(L•min),故A错误;
B.t1min与t2min时CO的物质的量相同,则到 t1min 时,反应达到平衡状态,故B错误;
C.K=$\frac{0.2×0.2}{0.4×0.1}$=1,温度升至 800℃时,上述反应的平衡常数为 0.64,可知升高温度,平衡逆向移动,则正反应为放热反应,故C正确;
D.保持 700℃不变,向平衡体系中再通入 0.60 mol CO 和 0.30 mol H2O,Qc=$\frac{0.2×0.2}{0.7×0.25}$=0.23<K,平衡正向移动,设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1.4 0.5 0.4 0.4
转化 x x x x
平衡 1.4-x 0.5-x 0.4+x 0.4+x
K不变,可知(1.4-x)(0.5-x)=(0.4+x)(0.4+x),解得x=0.2mol,
原平衡CO的转化率为$\frac{0.4}{1.2}$×100%=33.3%,总过程中CO的转化率为$\frac{0.4+0.2}{1.2+0.6}$×100%=33.3%,转化率不变,
原平衡时氢气的体积分数为$\frac{0.4}{0.8+0.2+0.4+0.4}$×100%=22.2%,后平衡时氢气的体积分数为$\frac{0.6}{1.2+0.3+0.6+0.6}$×100%=22.2%,即转化率、体积分数均不变,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据应用、化学平衡三段法、速率及K的计算为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的难点,选项D也可利用等效平衡法处理,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| t | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.001 6 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨转变成碳纳米管为物理变化 | |
| B. | “滴水石穿,绳锯木断”不包含化学变化 | |
| C. | 232Th转化为233U是化学变化 | |
| D. | 将地沟油制成肥皂是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 品红溶液中分别通入SO2和Cl2,品红均褪色 | |
| B. | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | |
| C. | 分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结 | |
| D. | 溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
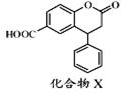
| A. | 可以与饱和Na2CO3溶液反应 | |
| B. | 分子中两个苯环一定处于同一平面 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1 mol化合物X最多能与3 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | NO3- | SO42- | H+ | Al3+ | Mn+ |
| 浓度(mol•L-1) | 3 | 4 | 2 | 2 | a |
| A. | Ag+、1.5 | B. | Mg2+、1.5 | C. | Ba2+、1.5 | D. | Fe3+、0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com