
【题目】下列物质中,既能与酸性KMnO4溶液反应,又能与溴水反应的是
①乙烷 ②苯 ③丙烯 ④邻二甲苯
A. ①②B. ③C. ②④D. 全部
科目:高中化学 来源: 题型:
【题目】海带中提取碘的一种流程如下:

(1) “操作Ⅰ”的主要目的的是获得含I-的溶液,它包括灼烧、水浸。其中灼烧时装置如右图所示,仪器A的名称为__。

(2)“置换”所得滤渣中含有Fe和Ag。
①使用化学方法分离出Ag操作是__。
②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为__。
(3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡静置,__。
(4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是__。
【答案】 坩埚 将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤 3Ag+4H++NO![]() =3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
=3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
【解析】流程分析:海带中提碘的操作为,先灼烧海带,再水浸溶解,过滤除去不溶性杂质,得到含I-的溶液。加入硝酸银溶液沉淀I-,得到AgI沉淀,此为富集碘的过程。再向AgI固体中加入过量的铁和水,不断的搅拌,反应生成Ag单质固体和FeI2溶液,过滤,滤液为FeI2溶液,滤渣为Ag和未反应完的Fe。向滤液FeI2中通入Cl2,生成I2和FeCl3(或FeCl2);加入CCl4萃取,分液分离得到I2的CCl4溶液。
(1)图中A为坩埚;
(2)①滤渣中含有Fe和Ag,可以利用Fe和Ag的活泼性不同,用酸将二者分离。Fe与稀硫酸、盐酸反应,而Ag不反应,故可以用稀硫酸或盐酸分离Fe和Ag。具体操作为:将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤;
②Ag可以和稀硝酸反应生成AgNO3、NO和水,离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O;
(3)操作II为加入CCl4萃取,有机层为I2的CCl4溶液。CCl4的密度大于水,先将下层的有机溶液放入烧杯中,再将上层液体从上口倒出。具体操作为:打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中;
(4)可以利用KSCN检验溶液中是否含有Fe3+,具体操作为为:取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+。
【题型】综合题
【结束】
25
【题目】利用钛白工业的副产品FeSO4[杂质仅为少量[Fe2(SO4)3]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

(1)用离子方程式表示“除杂”的原理:__。
(2) “沉淀”过程控制反应温度为40℃,温度不宜过高的原因是__。
(3)实验室测定副产品FeSO4杂质仅为少量[Fe2(SO4)3]+ Fe2(SO4)3含量的步骤如下:
步骤1:将适量副产品配成水溶液,向其中加入2molL-1BaCl2溶液使SO42-沉淀完全,过滤。
步骤2:将步骤1所得沉淀洗涤,烘干至恒重,称得其质量为11.65 g。
步骤3:用0.2000molL-1KMnO4溶液与步骤1所得滤液作用,恰好完全反应时消耗其体积为20.00 mL。
(该步骤中反应的方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2++4H2O)
①步骤1中证明SO42-沉淀完全的操作为__。
②欲配制0.2000 molL-1 KMnO4 50 mL,若定容时俯视,则所配KMnO4溶液浓度会__。(填“偏大”、“偏小”、“不变”)
③该副产品中所含杂质Fe2(SO4)3的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
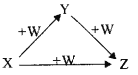
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等.化学在解决雾霾污染中有着重要的作用.
(1)已知:2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol ﹣12NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)△H=kJmol﹣1 .
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= .
(2)如图1是一种用NH3脱除烟气中NO的原理. 
①该脱硝原理中,NO最终转化为H2O和(填化学式).
②当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为L.
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径.在不同条件下,NO的分解产物不同.在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示,写出NO分解的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
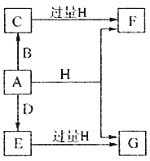
(1)A所含元素在周期表中的位置为______________,C的电子式为_______________。
(2)A与H在加热条件下反应的化学方程式为__________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为____________________。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为__________________。
(4)向含有0.4molF、0.1molG的混合溶液中加入过量盐酸,完全反应后收集到aL气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属Cu。实验流程如图所示(部分生成物已略):

(1)合金属于________________(填“纯净物”或“混合物”)。
(2)生活中铝比铁更耐腐蚀的原因___________(用化学反应方程式解释)。
(3)步骤A化学反应方程式表示为:2Al+2NaOH+2R=== 2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为________。
(4)步骤B发生的化学反应方程式为___________;反应的基本类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 棉、丝、毛、油脂都是天然有机高分子化合物
B. 聚氯乙烯塑料可用来做蔬菜水果及熟食等的保鲜膜
C. 纤维素、淀粉都可用(C6H10O5)n表示,它们互为同分异构体
D. 碱性条件下,葡萄糖与新制氢氧化铜溶液混合加热,生成砖红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com