
【题目】亚氯酸钠![]() 用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成
用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用.已知
都具有漂白作用.已知![]() ,经测定
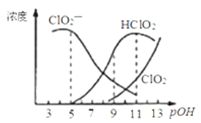
,经测定![]() 时各组分含量随pOH变化情况如图所示
时各组分含量随pOH变化情况如图所示![]() 没有画出
没有画出![]() ,此温度下,下列分析正确的是
,此温度下,下列分析正确的是![]()
![]()
A.![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
B.亚氯酸钠在酸性条件下较稳定
C.![]() 时,溶液中含氯微粒的浓度大小为:
时,溶液中含氯微粒的浓度大小为:![]()
D.同浓度的![]() 溶液和
溶液和![]() 溶液等体积混合,则混合溶液中有
溶液等体积混合,则混合溶液中有![]()
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A.蔗糖中滴入浓硫酸,搅拌变黑;C12H22O11+H2O![]() 2C6H12O6(葡萄糖)
2C6H12O6(葡萄糖)
B.湿润的KI淀粉试纸遇Cl2变蓝:2KI+Cl2=2KCl+I2
C.乙烯通入Br2的CCl4溶液中,橙红色褪去;CH2=CH2+Br2![]()
![]()
D.铜丝在酒精灯上灼烧变黑后立刻插入乙醇后又变为光亮的紫红色:2Cu+O2![]() 2CuO,CH3CH2OH +CuO
2CuO,CH3CH2OH +CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.已知2C(s)+2O2(g)=2CO2(g)△H=a kJmol-1,2C(s)+O2(g)=2CO(g)△H=b kJmol-1,则a>b
B.石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D.4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别243kJmol-1和498kkJmol-1,则可推算出H-O键的键能比H-Cl键的键能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
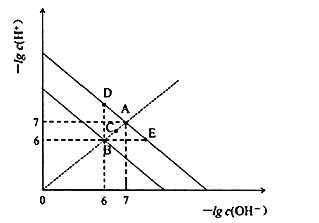
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6=3Na++AlF63-。现有冰晶石的结构单元如图所示,![]() 位于大立方体顶点和面心,
位于大立方体顶点和面心,![]() 位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中
位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中![]() 、
、![]() 中的一种。下列说法正确的是( )
中的一种。下列说法正确的是( )
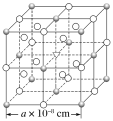
A.冰晶石是原子晶体
B.大立方体的体心处▽代表Al3+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度为![]() ×1024g·cm-3
×1024g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超纯氢氟酸主要用作芯片材料清洗和蚀刻。回答下列问题:
(1)氢氟酸可保存在聚四氟乙烯容器中,聚四氟乙烯的结构简式为_____________________。
(2)工业氢氟酸生产超纯氢氟酸时,需经除杂质(AsF3)、气化、洗涤等步骤。
①除去AsF3的反应为4AsF3+4KMnO4=4MnO4+2As2O5+4KF+3O2↑,该反应的氧化产物为___________。
②CoF3可与H2O反应生成HF,该反应的化学方程式为___________________________(CoF3还原为CoF2)
③在无水氟化氢汽化时,可向发生装置中掺入含有F2,NF3和OF2中的一种或多种的含氟气体,以氧化杂质。NF3的电子式为_________;OF2中氧元素的化合价为___________,OF2可由F2与稀NaOH溶液反应制取,该反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
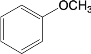
【题目】去甲肾上腺素是一种重要的神经递质,以石油裂解产物A和邻甲氧基苯酚为原料,经过中间体藜芦醛,合成去甲肾上腺素的路线如下所示。
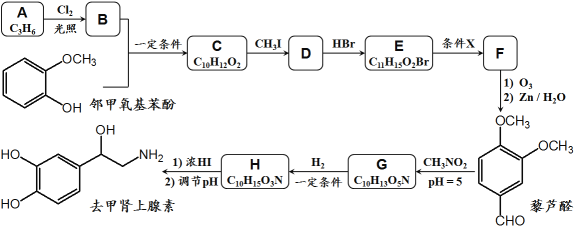
已知:①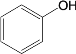
![]()
![]()

②![]()
![]()
![]() +
+![]()
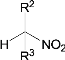
③![]() +
+
![]()
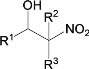
④D和F互为同分异构体。
回答下列问题:
(1)C → D的反应类型为__________,G → H的反应类型为__________;
(2)条件X为__________,E在条件X作用下发生变化的官能团名称为__________;
(3)关于上述合成,下列说法正确的是__________;(填序号)
a.1mol邻甲氧基苯酚能与3mol Br2发生取代反应
b.合成路线中CH3I和浓HI的作用是保护酚羟基不被O3氧化
c.藜芦醛分子中至少有14个原子共平面
d.1mol去甲肾上腺素熔化后至多可消耗3mol Na和2mol NaOH
(4)B + 邻甲氧基苯酚 → C的化学方程式为_______________________________;
(5)藜芦醛的同系物Y相对分子质量比藜芦醛大14,写出Y满足下列条件所有同分异构体的结构简式:
①能发生银镜反应;②1mol该有机物能消耗2mol NaOH(aq);③核磁共振氢谱有4组峰
__________________________________________________________;
(6)试设计以间苯二酚(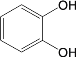 )为原料,制备聚酯
)为原料,制备聚酯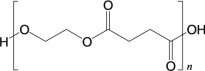 的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA为阿伏加德罗常数的值)
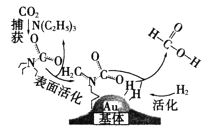
A.10.1gN(C2H5)3中所含的共价键数目为2.1NA
B.标准状况下,22.4LCO2中所含的电子数目为16NA
C.在捕获过程中,二氧化碳分子中的共价键完全断裂
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,人类可以从海水中提取各种化工产品。下图是某工厂对海水综合利用的示意图:
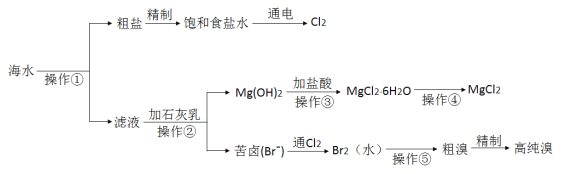
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________,检验氯气生成的方法是_________。
(2)液氯储存在钢瓶中,钢瓶上应贴的标签为_________________(选填编号)。
a.自燃品 b.爆炸品 c.有毒品 d.易燃品
(3)Mg(OH)2加入盐酸充分反应后,操作③ 是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为____________________________。
(4)操作④是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因________________。
(5)操作⑤是向溶液中鼓入__________,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有____________性。
(6)粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br,再通Cl2,最后蒸馏得到高纯溴。用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为_________。由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com