
氨、甲烷都是重要的氢化物,按要求回答下列问题:
(1)NH3(g)和O2(g)反应生成NO(g)和H2O(g)的△H往往难以直接测量,从产物稳定性看,其主要原因是 .
已知:1molN2(g)反应生成2mol NH3(g)的△H=﹣92kJ•mol﹣1,1mol H2(g)燃烧生成H2O (g) 的△H=﹣242kJ•mol﹣1,1mol N2(g)和O2 (g)完全反应生成NO(g)的△H=+180kJ•mol﹣1.若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 .
(2)甲烷与水蒸气通入聚焦太阳能反应器,可发生反应的化学方程式为CH4+H2O⇌CO+3H2,该反应为吸热反应.已知在三种不同条件(Ⅰ、Ⅱ、Ⅲ)下,氢气的产量随时间的变化如图1所示.
①在0~20小时内,甲烷的反应速率vⅠ、vⅡ和vⅢ从大到小的顺序为 .
②将0.4mol甲烷和0.4mol水蒸气充入2L恒容的密闭容器中,某条件下反应达到平衡,测得氢气的物质的量浓度为0.3mol•L﹣1,则该条件下此反应的平衡常数K= ,甲烷的转化率为 .
③氢气的百分含量与体系总压强(P)、温度(T)的关系如图2所示.
平衡状态由A变到B时,对应的平衡常数:K(A) K(B)(填“>”、“<”或“=”).
| 化学平衡的影响因素;反应热和焓变.. | |
| 专题: | 基本概念与基本理论. |
| 分析: | (1)产物中的一氧化氮极易被氧化,所以难以直接测量;应用盖斯定律求解; (2)①相同时间氢气的产量的变化量越大,表明平均速率越大,相同时间氢气的物质的量的变化量越小,平均反应速率越小; ②根据三行式求平衡时各物质的浓度,然后代入平衡常数表达式,根据转化率公式求甲烷的转化; ③根据图象判断A、B两点温度的高低,然后结合正反应是吸热反应综合分析. |
| 解答: | 解:(1)产物中的一氧化氮极易被氧化,所以难以直接测量,N2(g)+3H2(g)═2NH3(g)△H=﹣92KJ•mol﹣1①, 2H2(g)+O2 (g)=2H2O (g)△H=﹣484kJ•mol﹣1②, N2(g)+O2 (g)=2NO(g)△H=+180kJ•mol﹣1③, 所以4NH3(g)+5O2 (g)=4NO(g)+6H2O (g)△H=﹣①×2+②×3+2×③=92×2+(﹣484)×3+2×180=﹣908kJ•mol﹣1, 则4molNH3(g)经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为908kJ,所以17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为227 kJ, 故答案为:NO容易被氧气氧化生成二氧化氮,无法控制产物,所以难以直接测量;227 kJ; (2)①相同时间氢气的产量的变化量越大,表明平均速率越大,相同时间氢气的物质的量的变化量越小,平均反应速率越小,由图1可知变化量最大的是Ⅰ,最小的是Ⅲ,所以甲烷反应速率大小为vⅠ>vⅡ>vⅢ,故答案为:vⅠ>vⅡ>vⅢ; ②CH4 +H2O⇌CO+3H2 初起量:0.2mol•L﹣1 0.2mol•L﹣1 0 0 变化量:0.1mol•L﹣1 0.1mol•L﹣1 0.1mol•L﹣1 0.3mol•L﹣1 平衡量:0.1mol•L﹣1 0.1mol•L﹣1 0.1mol•L﹣10.3ol•L﹣1 所以K= 故答案为:0.27 mol2•L﹣2;50%; ③由A到C,氢气的百分含量增加,所以温度升高,即T1>T2,正反应是吸热反应温度越高K值越大,故答案为:<. |
| 点评: | 本题考查盖斯定律的应用、化学反应速率大小的比较、平衡常数、转化率和图象的分析,综合性强,但难度中等. |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
)镁铝合金在交通、航空、电子等行业有着广泛的应用。某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。镁铝合金废料转化为硫酸铝晶体实验流程如下:
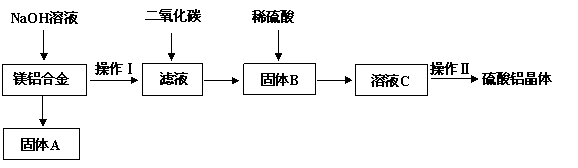
试回答下列问题:
(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式 ▲ ,固体B的化学式 ▲ 。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、 ▲ 、 ▲ 、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 ▲ 。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。计算得硫酸铝晶体的化学式为 ▲ 。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知: 。
。
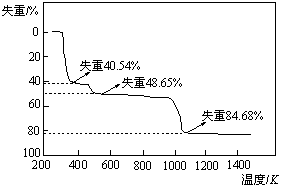 根据图示数据计算确定每步分解的产物,写
根据图示数据计算确定每步分解的产物,写
出第一阶段分解产物的化学式 ▲ ,第三阶段反应化学方程式 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )
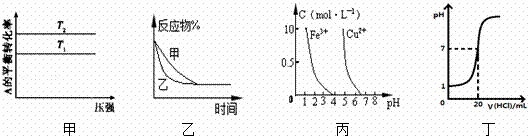
|
| A. | 图甲可以判断出反应A(g)+B(g)⇌若2C(g)的△H<0,T2>T1 |
|
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响.乙的压强比甲的压强大 |
|
| C. | 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH≈4 |
|
| D. | 图丁表示25℃时,用0.1 mol/L叫盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2 |
|
| B. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
|
| C. | 500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) |
|
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2589.6kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列实验的描述正确的是( )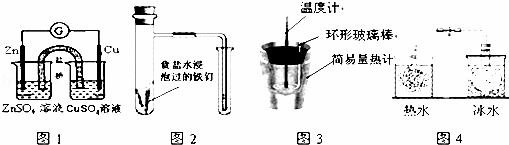
|
| A. | 图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu的金属活泼性 |
|
| B. | 图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
|
| C. | 图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热 |
|
| D. | 图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)⇌N2O4(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
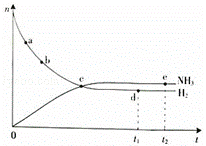
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如右下图所示.
下列叙述正确的是 (填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2 (g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②合成氨工业中采用了较高压强(20MPa~50MPa),而没有采用100MPa或者更大压强,试解释没有这么做的理由 .
③在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示,化简为最简式),此时α甲 α乙(填“>”、“<”“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X,Y,Z均为短周期元素,X,Y处于同一周期,X,Z的最低价离子分别为X2﹣和Z﹣,Y+和Z﹣具有相同的电子层结构.下列说法正确的是( )
|
| A. | 原子最外层电子数:X>Y>Z | B. | 单质沸点:X>Y>Z |
|
| C. | 离子半径:X2﹣>Y+>Z﹣ | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切.
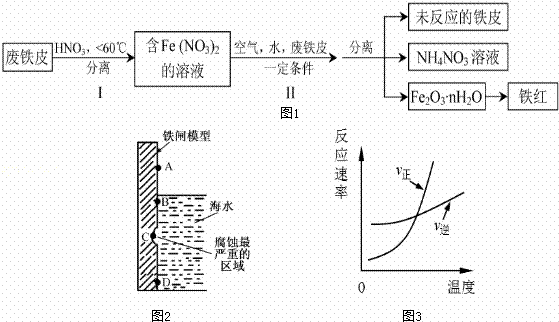
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
0.100 mL 6 mol·L-1 H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量下列物质中的:①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液⑤醋酸钠固体 ⑥硫酸铜固体 ( )A. ②③⑤ B. ①④⑤ C. ②③⑥ D. ③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com