
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A和B的原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________;B________;
C________;D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大到小的顺序是__________________________________________。
(3)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是__________________________________________。
科目:高中化学 来源: 题型:
某同学在学习等径球最密堆积(立方最密堆积A1和六方最密堆积A3)后,提出了另一种最密堆积形式Ax 。如右图所示为Ax 堆积的片层形式,然后第二层就堆积在第一层的空隙上。请根据Ax 的堆积形式回答:
(1)计算在片层结构中(如右图所示)球数、空隙数和切点数之比
(2)在Ax 堆积中将会形成正八面体空隙和正四面体空隙。请在片层图中画出正八面体空隙(用·表示)和正四面体空隙(用×表示)的投影,并确定球数、正八面体空隙数和正四面体空隙数之比
(3)指出Ax 堆积中小球的配位数
(4)计算Ax 堆积的原子空间利用率。
(5)计算正八面体和正四面体空隙半径(可填充小球的最大半径,设等径小球的半径为r)。
(6)已知金属Ni晶体结构为Ax 堆积形式,Ni原子半径为124.6 pm,计算金属Ni的密度。(Ni的相对原子质量为58.70)
(7)如果CuH 晶体中Cu+的堆积形式为Ax 型,H- 填充在空隙中,且配位数是4。则H- 填充的是哪一类空隙,占有率是多少?
(8)当该同学将这种Ax 堆积形式告诉老师时,老师说Ax 就是A1或A3的某一种。你认为是哪一种,为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
在烷烃分子中的基团: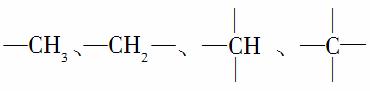 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如:
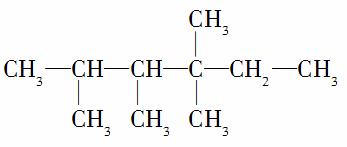
分子中,N1=6,N2=1,N3=2,N4=1。试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子数N0与N1、N2、N3、N4之间的关系是N0=________________________________________________________。
(2)4种碳原子数之间的关系为N1=_______________________。
(3)若分子中N2=N3=N4=1,则该分子的结构简式可能为(任写一种)________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.乙醇分子可以看作是乙烷分子中的一个氢原子被—OH取代而形成的
B.乙醇分子中的氢原子都可以被钠置换
C.—OH和OH-两种微粒中质子数、电子数都相等
D.水和乙醇分子中的羟基化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在周期表的位置如图所示,则下列说法正确的是( )
| X | ||
| Y | ||
| Z |
A.Z一定是活泼的金属
B.X的最高价氧化物的水化物是一种强酸
C.由Z的最高价氧化物形成的水化物是强酸
D.Y单质很难与H2化合
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
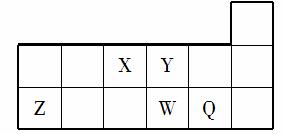
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质的叙述中正确的是( )
A.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
B.胆矾不能导电,所以它属于非电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.强电解质都是离子化合物,弱电解质都是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液
③ NaF溶液 ④ NaClO溶液。依据数据判断pH由大到小的顺序是 。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.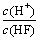 D.
D.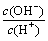
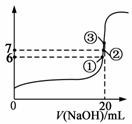 (3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
(3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
A.pH=3的HF溶液和pH=11的NaF溶液中,
由水电离出的c(H+)相等
B.在①点时pH=6,此时溶液中,
c(F-)-c(Na+) = 9.9×10-7mol/L
C.在②点时,溶液中的c(F-) = c(Na+)
D.在③点时V=20mL,此时溶液中c(F—) < c(Na+)=0.1mol/L
(4)在25℃时,Ksp[Cu(OH)2] =2.0×10-20。 某CuCl2溶液里C(Cu2+)= 0.02 mol·L-1,
如果要生成Cu(OH) 2沉淀,应调整溶液的pH使之大于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热ΔH为-57.3 kJ/mol,辛烷的标准燃烧热为-5 518 kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
B.KOH(aq)+ H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
C.C8H18(l)+ O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com