
| A. | c=$\frac{ρ•w}{M}$ | B. | c=$\frac{ρ•M}{w}$ | C. | c=$\frac{M}{m•V}$ | D. | c=$\frac{m}{M•V}$ |
分析 根据m(溶质)=m(溶液)•w(溶质)=Vρ•w(溶质)计算溶质的质量,根据n=$\frac{m}{M}$计算溶质物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:体积为VL、密度为ρg/cm3的某溶液中,溶质的质量分数为w,则m(溶质)=1000ρVw g,溶质摩尔质量为M,则溶质物质的量=$\frac{1000ρVw}{M}$,故溶液浓度c=$\frac{\frac{1000ρVw}{M}mol}{VL}$=$\frac{1000ρw}{M}$mol/L,
溶液中溶质质量为m,则溶质物质的量可以表示为$\frac{m}{M}$,故溶液的浓度c=$\frac{\frac{m}{M}}{v}$mol/L=$\frac{m}{MV}$mol/L,
故选D.
点评 本题考查物质的量浓度、质量分数计算,属于字母型计算,增大计算难度,注意理解掌握物质的量浓度与质量分数之间关系,难度中等.


科目:高中化学 来源: 题型:选择题
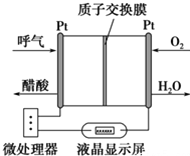 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| B. | 该电池的正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol•L-1•min-1 | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.
草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
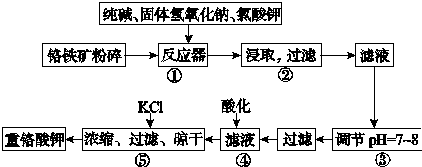
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com