
 (1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.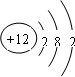 .
.分析 (1)①元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”,推断为镁;
②以Mg、Al为电极,KOH溶液为电解质溶液,则负极为Al;
(2)①根据盖斯定律来计算化学反应的焓变;
②根据图示内容对比260℃时SO2的转化率来寻找反应速率最快,根据催化剂和二氧化硫转化率之间的关系来判断Fe2O3作催化剂的优点;
③Ⅰ、根据化学方程式结合物质的量之间的关系来计算;
Ⅱ、根据SO32-+H+?HSO3-平衡常数K来计算即可.
解答 解:(1)①元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”,推断为镁,镁原子为12号元素,原子结构示意图为 ,
,
故答案为: ;
;
②以Mg、Al为电极,负极的电极反应式为:Al+4OH--3e-=[Al(OH)4]-,故答案为:Al+4OH--3e-=[Al(OH)4]-;
(2)①已知①2CO(g)+O2(g)=2CO2(g)△H1=-566kJ•mol-1
②(l)+O2(g)=SO2(g)△H2=-296kJ•mol-1
反应2CO(g)+SO2(g)?2CO2(g)+S(l)可以是①-②所得,所以该反应的焓变△H=-566kJ•mol-1-(-296kJ•mol-1)=-270kJ•mol-1,
故答案为:-270;
②根据图示内容,对比260℃时不同催化剂作用下SO2的转化率,可以看出Cr2O3作催化剂时,反应速率最快,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,但是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率,从而节约大量能源,
故答案为:Cr2O3;Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率,从而节约大量能源;
③Ⅰ、当溶液中c(SO32-)的浓度降至0.2mol•L-1时,亚硫酸氢钠的生成浓度是1.6mol/L,故答案为:1.6;
Ⅱ、根据SO32-+H+?HSO3-平衡常数K=$\frac{c(HS{{O}_{3}}^{-})}{c({H}^{+})c(S{{O}_{3}}^{2-})}$,所以c(H+)=$\frac{1.6}{0.2×8×1{0}^{6}}$mol/L=10-6mol/L,即此时溶液的pH=6,故答案为:6.
点评 本题考查学生有关热化学、化学反应速率、弱电解质的电离等方面的知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.
(1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清溶液中:AlO2-、SO42-、Na+、HCO3- | |
| B. | 在由水电离出的c(OH-)=10-13 mol•L-1的溶液中:I-、K+、Cl-、Ba2+ | |
| C. | 滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- | |
| D. | c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com