
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整_________。
(2)实验中他们取6.4 g铜片和12 mL 18 mol·L1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是__________________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是________(填编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)装置C中试管D内盛装的是品红溶液,当B中气体收集满后,有可能观察到的现象是_____________,待反应结束后,向C中烧杯内加入沸水,D中观察到的现象是_____________。
(4)实验装置C有可能造成环境污染,试用最简单的方法加以解决,__________________(实验用品自选)。
【答案】(1)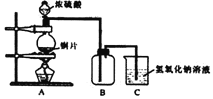
(2)①Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ ②随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸,反应停止;③AD(3)红色褪去,恢复红色(4)用浸有NaOH的溶液的面团塞在试管口 (合理均可)
CuSO4+2H2O+SO2↑ ②随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸,反应停止;③AD(3)红色褪去,恢复红色(4)用浸有NaOH的溶液的面团塞在试管口 (合理均可)
【解析】
试题(1)铜跟浓硫酸反应生成了SO2气体,SO2比空气重,可以用向上排气法收集,所以装置中的导气管应长进短出,装置图为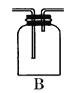 ;(2)①铜跟浓硫酸在加热时发生反应,反应的化学方程式是Cu+2H2SO4(浓)
;(2)①铜跟浓硫酸在加热时发生反应,反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;②6.4g铜片的物质的量是0.1mol,该铜和12ml 18mol/L浓硫酸放在圆底烧瓶中共热,依据化学反应方程式Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑;②6.4g铜片的物质的量是0.1mol,该铜和12ml 18mol/L浓硫酸放在圆底烧瓶中共热,依据化学反应方程式Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑的定量关系可知,0.1mol铜与含2.16mol硫酸的浓硫酸反应,最后发现烧瓶中还有铜片剩余,说明一定剩余酸,这是因为浓硫酸随着反应进行,浓度变小成为稀硫酸,不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解;③根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子,A.铁粉与氢离子反应产生气泡,正确;B.BaCl2溶液只能与硫酸根产生沉淀,无论硫酸是否过量,都会发生沉淀反应,因此不能证明硫酸是否过量,错误;C.银粉不反应,无现象,不能证明硫酸是否过量,错误;D.Na2CO3溶液与氢离子反应产生气泡,正确。(3) 装置C中试管D内盛装的是品红溶液,当B中气体收集满后,SO2进入品红溶液,使品红溶液褪色;待反应结束后,向C中烧杯内加入沸水,升高温度,无色物质不稳定,受热分解,SO2逸出,品红溶液又变为红色;(4)实验装置C有可能造成环境污染,由于SO2是酸性氧化物,可以与碱发生反应产生盐和水,因此可以用浸有NaOH的溶液的面团塞在试管口。
CuSO4+2H2O+SO2↑的定量关系可知,0.1mol铜与含2.16mol硫酸的浓硫酸反应,最后发现烧瓶中还有铜片剩余,说明一定剩余酸,这是因为浓硫酸随着反应进行,浓度变小成为稀硫酸,不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解;③根据反应后必有硫酸铜产生,所以要证明反应结束后的烧瓶中确有余酸,只有证明氢离子,A.铁粉与氢离子反应产生气泡,正确;B.BaCl2溶液只能与硫酸根产生沉淀,无论硫酸是否过量,都会发生沉淀反应,因此不能证明硫酸是否过量,错误;C.银粉不反应,无现象,不能证明硫酸是否过量,错误;D.Na2CO3溶液与氢离子反应产生气泡,正确。(3) 装置C中试管D内盛装的是品红溶液,当B中气体收集满后,SO2进入品红溶液,使品红溶液褪色;待反应结束后,向C中烧杯内加入沸水,升高温度,无色物质不稳定,受热分解,SO2逸出,品红溶液又变为红色;(4)实验装置C有可能造成环境污染,由于SO2是酸性氧化物,可以与碱发生反应产生盐和水,因此可以用浸有NaOH的溶液的面团塞在试管口。


科目:高中化学 来源: 题型:
【题目】实验室常用锌和稀硫酸反应制取氢气。在2mol/L的足量稀硫酸跟一定量的锌片反应制取氢气的实验中,为加快反应速率,又不影响生成氢气的总量,可以采用的方法是( )
A.适当升高温度B.加入几滴硫酸铜溶液
C.再加入少量浓硝酸D.加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能满足表中图示物质在一定条件下一步转化关系的组合为
组别 | X | Y | Z | W |
|
A | Al | AlCl3 | Al(OH)3 | Al2O3 | |
B | Na | Na2O2 | Na2CO3 | NaCl | |
C | Fe | FeCl2 | FeCl3 | Fe(OH)3 | |
D | Si | Na2SiO3 | H2SiO3 | SiO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述错误的是

A. a电极是负极,该电极上发生氧化反应
B. b极反应是O2+2H2O-4e-=4OH-
C. 总反应方程式为2H2+O2=2H2O
D. 使用过程中电解质溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有丰富多彩的化学性质。回答下列问题:
(1)铁元素在周期表中的位置为第______周期_____族。
(2)FeCl3溶液可用于吸收尾气中的SO2,写出该反应的离子方程式:_________。
(3)某化学兴趣小组同学用如图装置,充分加热硫酸亚铁晶体(FeSO4·xH2O)至完全分解。

① 装置A中需持续通入N2,其目的是______________________________。
② 充分反应一段时间后,小组同学观察到实验现象为:装置A中残留有红棕色固体,装置B中固体变蓝,C中溶液褪色,请写出FeSO4分解的化学方程式:______________。
③ 装置D中干燥管的作用为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,其密度小于lg/ml,沸点约55℃,分离水和丙酮最合理的方法是
A. 蒸发 B. 分液 C. 蒸馏 D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸水性高分子材料PAA、接枝PAA、用于化妆品的化合物己的合成路线如图:

已知:
Ⅰ.连在同一个碳原子上的两个羟基之间容易失去一分子水
Ⅱ.两个羧酸分子的羧基之间能失去一分子水
Ⅲ.
请回答:
(1)D中的官能团是______________
(2)D→E的化学方程式是_____________________________________
(3)F→PAA的化学方程式是___________________________
(4)①X的结构简式是_________
②Y→W所需要的反应条件是______________________
(5)B为中学常见有机物,甲与FeCl3溶液发生显色反应,丙中的两个取代基互为邻位.
①甲→乙的化学方程式是________________________________________
②关于丙的说法正确的是________
a.能与银氨溶液发生银镜反应
b.与有机物B互为同系物
c.不存在芳香醇类的同分异构体
(6)丁的核磁共振氢谱只有一种峰,在酸性条件下能水解,水解产物能与NaHCO3反应产生CO2.己的结构简式是______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com