
| A. | 8 种 | B. | 9 种 | C. | 10 种 | D. | 12 种 |
分析 有机物C4H9C1O的同分异构体中能与Na反应放出氢气,说明其分子中含有羟基,先写出丁醇的同分异构体,然后根据丁醇中等效H原子判断其一氯代物即可(注意不考虑羟基与氯原子在同一个碳原子上).
解答 解:有机物C4H9C1O的同分异构体中能与Na反应放出氢气,说明其分子中含有羟基,该有机物可以看作Cl原子取代丁醇中氢原子形成的,
丁醇的同分异构体有:CH3CH2CH2CH2OH、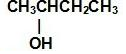 、
、 、CH3(CH3)CHCH2OH,
、CH3(CH3)CHCH2OH,
CH3CH2CH2CH2OH分子的烃基中含有4种等效H原子,不考虑羟基与氯原子在同一个碳原子上时,其一氯代物有3种;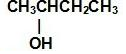 分子的烃基中含有4种H原子,不考虑羟基与氯原子在同一个碳原子上时,其一氯代物有3种;
分子的烃基中含有4种H原子,不考虑羟基与氯原子在同一个碳原子上时,其一氯代物有3种; 分子中的烃基中含有1种H原子,其一氯代物有1种;
分子中的烃基中含有1种H原子,其一氯代物有1种;
CH3(CH3)CHCH2OH分子的烃基上含有3种等效H,不考虑羟基与氯原子在同一个碳原子上时,其一氯代物有2种,
根据分析可知,有机物C4H9C1O的同分异构体中能与Na反应放出氢气的共有:3+3+1+2=9,
故选B.
点评 本题考查了同分异构体的书写,题目难度不大,明确同分异构体的书写原则为解答关键,注意掌握常见有机物组成与结构,试题培养了学生的分析能力及逻辑推理能力.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
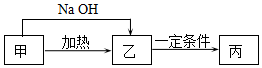 甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.
甲、乙、丙3种物质在生产生活中用途广泛,它们均是由短周期元素组成的化合物.甲含有4种元素,其中一种元素原子的最外层电子数是内层的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰的主要成分是H2O | B. | SO2可大量用于漂白食品 | ||
| C. | 吸入CO可导致人体中毒 | D. | 小苏打的主要成份是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池中阳离子向通入CH3OH一方的电极区域内移动 | |
| B. | 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是天然气的主要成分,能发生取代反应,但不能发生氧化反应 | |
| B. | 实验室中,可用金属钠检验乙醇中是否含有水 | |
| C. | 只用水无法鉴别苯、乙酸和四氯化碳 | |
| D. | 植物油不能用于萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | “吹出”采用热空气而不是常温空气的原因是热空气氧化性强 | |
| B. | 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1:5 | |
| C. | 第③步中“酸化”要用强氧化性的酸,如硝酸 | |
| D. | 含溴的水溶液B中的单质溴浓度比A中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国古代四大发明之一黑火药由硫酸、硝酸和木炭按一定比例混合制成 | |
| B. | PH计不能用于酸碱中和滴定终点的判断 | |
| C. | 石油的分馏,煤的干馏、气化、液化均是物理变化 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
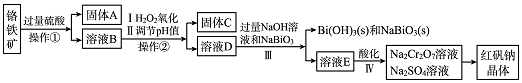
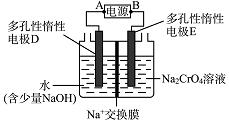
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
 ;元素⑨形成的氢化物的电子式
;元素⑨形成的氢化物的电子式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com