
| A | B | C | D |
 |  |  |  |
| 向该装置中加入金属Zn和稀硫酸,并关闭活塞,用于检查装置的气密性 | 用该装置制备少量白色的Fe (OH)2沉淀 | 灼烧CuSO4使其分解 | 分离葡萄糖和蔗糖 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.应在加入药品之前检查气密性;
B.铁被氧化生成亚铁离子,阴极生成氢气和氢氧化钠,可生成氢氧化亚铁;
C.应在坩埚中加热固体;
D.葡萄糖和蔗糖都能透过半透膜.
解答 解:A.检查气密性,不能先加入药品,可利用压强差原理检验,故A错误;
B.铁被氧化生成亚铁离子,阴极生成氢气和氢氧化钠,可生成氢氧化亚铁,故B正确;
C.蒸发皿用于加热液体,应在坩埚中加热固体,故C错误;
D.葡萄糖和蔗糖都能透过半透膜,不能用渗析的方法分离,故D错误.
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及气密性的检查、物质的制备以及分离等知识点,明确实验原理、实验操作规范性及物质性质是解本题关键,侧重考查实验基本操作,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )
钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )| A. | O2在正极参加反应,生成OH- | |
| B. | 钢铁生锈过程中电能转化为化学能 | |
| C. | 负极的电极反应式为:Fe-3e -=Fe3+ | |
| D. | 为减缓铁制品生锈,可将其与铜相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为113 | B. | 质子数为113 | ||
| C. | 相对原子质量为113 | D. | 中子数为113 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | |
| B. | 1mol N2和3mol H2的总能量低于2mol NH3的总能量 | |
| C. | 达到化学反应限度时,生成2molNH3 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S为还原剂被氧化,MnO4-为氧化剂被还原 | |
| B. | 氧化剂和还原剂物质的量之比为2:1 | |
| C. | 反应中每消耗1 mol Cu2S,转移8 mol电子 | |
| D. | 滴定时可以不加其他的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
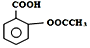 所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 该化合物的分子式为C9H10O4 | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 与乙酰水杨酸具有相同官能团,且苯环上只有两个取代基的芳香族同分异构体共有8种(不考虑立体异构) | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用小苏打溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法:
亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl2-$?_{放电}^{充电}$2VCl3+Br-.
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl2-$?_{放电}^{充电}$2VCl3+Br-.| A. | VCl2存储在正极储液罐内 | |
| B. | 放电时H+从负极区移至正极区 | |
| C. | 充电时电池的负极与电源的负极相连 | |
| D. | 充电时阳极反应为Br-+2Cl--2e-=BrCl2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com