
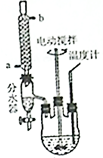
 某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下:
某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下: .
.分析 (1)草酸具有还原性能够被酸性的高锰酸钾氧化生成二氧化碳,高锰酸根离子被还原为二价锰离子;
(2)苯为有机溶剂,依据相似相溶原理可知苯可以溶解有机物;乙二酸与乙醇在浓硫酸最催化剂吸水剂条件下发生酯化反应生成草酸二乙酯和水;
(3)步骤3用饱和碳酸氢钠溶液,可以吸收草酸、硫酸等酸性物质;
(4)依据方程式计算解答.
解答 解:(1)草酸与酸性的高锰酸钾发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(2)草酸、乙醇为有机物易溶于苯,可以用苯做溶剂增大乙醇与草酸接触面积,乙二酸与乙醇在浓硫酸最催化剂吸水剂条件下发生酯化反应生成草酸二乙酯和水,方程式: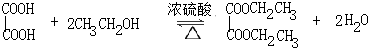 ;
;
故答案为:做溶剂;催化剂、吸水剂;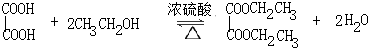 ;
;
(3)步骤3用饱和碳酸氢钠溶液,可以吸收草酸、硫酸等酸性物质;
故答案为:除去草酸、硫酸等酸性物质;
(4)根据反应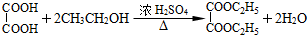
90 146
45g 73g
则本实验中,草酸二乙酯的产率为:$\frac{58.4g}{73g}$×100%=80%,
故答案为:80%.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、有机物的结构与性质、实验中混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1molCO 完全燃烧,放出热量为 283 J | |
| B. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$ O2(g)△H=-226 kJ•mol-1 | |
| C. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 1.204×1024 | |
| D. | CO 的燃烧热为 566 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2气体,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 氯气在水中溶解度大于饱和食盐水中的溶解度 | |
| D. | 由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 9g H2O 和0.5mol Br2D | D. | 224mLH2 (标准状况)和0.01mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 98.32kJ | B. | 196.64kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 银盐 性质 | AgCl | AgBr | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 砖红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
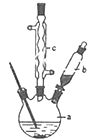 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线: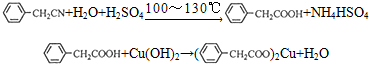
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
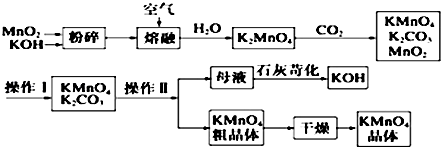
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com