
某温度下,对于反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是()
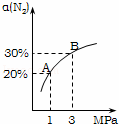
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B. 平衡状态由A变到B时,平衡常数K(A)<K(B)
C. 上述反应在达到平衡后,增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
考点: 转化率随温度、压强的变化曲线.
专题: 化学平衡专题.
分析: A、可逆反应反应物不能完全转化,结合热化学方程式的含义解答;
B、平衡常数只受温度影响,与压强无关;
C、增大压强平衡向体积减小的方向移动;
D、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动.
解答: 解:A、热化学方程式N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ/mol表示1mol氮气(g)以3mol氢气(g)反应生成2mol氨气(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,故A错误;
B、平衡常数只受温度影响,与压强无关,增大压强平衡常数不变,故平衡常数k(A)=k(B),故B错误;
C、增大压强平衡向体积减小的方向移动,即向正反应移动,H2的转化率提高,故C正确;
D、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动,故D错误;
故选C.
点评: 本题考查化学平衡图象、反应热计算、影响化学平衡与化学反应速率的因素等,难度中等,注意A中热化学方程式的意义.


科目:高中化学 来源: 题型:
Na2O2与水反应能够产生O2,这一反应在呼吸面具、潜水艇及太空飞船中可为人体提供呼吸所用的O2.下面对该反应的说法中正确的是( )
|
| A. | 这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂 |
|
| B. | 这是一个氧化还原反应,Na2O2是氧化剂,水是还原剂 |
|
| C. | 这是一个氧化还原反应,Na2O2是还原剂,水是氧化剂 |
|
| D. | 这是一个置换反应,有单质O2产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做()
A. 阴极 B. 阳极 C. 正极 D. 负极
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2O4+8H2O 3Zn(OH)2+2Fe(OH)3+2Fe(OH)3+4KOH下列叙述不正确的是()
3Zn(OH)2+2Fe(OH)3+2Fe(OH)3+4KOH下列叙述不正确的是()
A. 放电时负极反应为:3Zn﹣6e﹣+6OH﹣═3Zn(OH)2
B. 放电时正极反应为:2FeO42﹣+6e﹣+8H2O═2Fe(OH)3+10OH﹣
C. 放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
在C(固)+CO2(气)=2CO(气)的反应中.现采取下列措施:
(1)增大压强;(2)增加碳的量;(3)通入CO2;(4)恒容下充入N2;(5)恒压下充入N2,哪些措施能够使反应速率增大?()
A. (1)(3) B. (3)(5) C. (1)(2)(3) D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)⇌3C(g)+D(g),达到平衡状态的是()
A. 器内压强不随时间变化而变化
B. 反应器内A、B、C、D物质的量比为1:3:3:1
C. 生成A的速率和生成的D的速率相等
D. 生成 1mol A同时有3 mol C被消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g•cm﹣3,则盐酸的物质的量浓度是()
A. 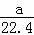 mol•L﹣1 B.
mol•L﹣1 B. 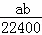 mol•L﹣1
mol•L﹣1
C. 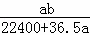 mol•L﹣1 D.
mol•L﹣1 D. 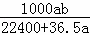 mol•L﹣1
mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe 和X.
(1)根据题意,可判断出X是 (写化学式).
(2)写出并配平该反应的化学方程式:
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com