
���¶�Ϊ373Kʱ����0.100mol��ɫ��N2O4�������1L��յ��ܱ������У����̳��ֺ���ɫ��ֱ������N2O4 2NO2��ƽ�⡣��ͼ�Ǹ�һ��ʱ��ⶨ����N2O4��Ũ�ȣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩
2NO2��ƽ�⡣��ͼ�Ǹ�һ��ʱ��ⶨ����N2O4��Ũ�ȣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩
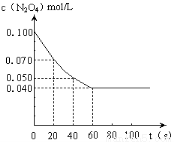
��1��������20��40��ʱ���ڣ�NO2��ƽ����������Ϊ mol?L-1?S -1��
��2���ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
������¶���ƽ�ⳣ����ֵ����д��������̣���ͬ��
��3����ﵽƽ��״̬ʱN2O4��ת���ʡ�
��4����ƽ��ʱ����������ѹǿ�뷴Ӧǰ��ѹǿ֮��Ϊ����?(���������)��
��1��0.002��2�֣���2����K= C2(NO2)/C(N2O4) ��2�֣� ��0.36��2�֣�
��3��60%��2�֣� ��4��8:5��2�֣�
��������
�����������1����ͼ���֪��20��40��ʱ����N2O4��Ũ����0.07mol/L��СΪ0.050mol/L��
���䷴Ӧ����Ϊ��0.07mol/L?0.05mol/L����20s=0.001mol/��L��s�����ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���NO2�ķ�Ӧ����Ϊ0.001mol/��L��s����2=0.002mol/��L��s�����ʴ�Ϊ��0.002��
��2����ƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���K=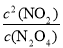 ���ʴ�Ϊ��K=
���ʴ�Ϊ��K=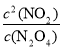 ��
��
�ڸ���ͼ���֪��Ӧ��60sʱ�ﵽƽ��״̬��ƽ��ʱ����N2O4��Ũ��Ϊ0.100mol/L��0.040mol/L��0.060mol/L�����Ը��ݷ���ʽ��֪����NO2��Ũ��Ϊ0.060mol/L��2��0.120mol/L�����ƽ�ⳣ��K��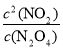 ��
��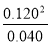 ��0.036��
��0.036��
��3���������Ϸ�����֪�ﵽƽ��״̬ʱN2O4��ת����Ϊ ��100%��60%��
��100%��60%��
��4�����ݰ����ӵ����ɿ�֪ƽ��ʱ����������ѹǿ�뷴Ӧǰ��ѹǿ֮��Ϊ ��8:5��
��8:5��
���㣺������淴Ӧ���йؼ���


 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����и���9��ѧ����л�ѧ�Ծ��������棩 ���ͣ������
��12�֣�����þ���ص��κ�ˮ���������õ��IJ����к���±ʯ��xKCl��yMgCl2��zH2O�������ڿ����м��׳��⣬������ˮ��������طʺ���ȡ����þ����Ҫԭ�ϣ�����ɿ�ͨ������ʵ��ⶨ��
��ȷ��ȡ5.550 g��Ʒ����ˮ�����100 mL��Һ��
�ڽ���Һ�ֳɶ��ȷݣ���һ���м���������NaOH��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����0.580 g��
������һ����Һ�м��������������ữ��AgNO3��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����4.305 g��
��1��������м����ɫ������ϴ���ķ����ǡ�
��2����֪ij�¶���Mg(OH)2��Ksp = 6.4��10��12������Һ��c(Mg2+)��1.0��10��5 mol��L��1 ����Ϊ������ȫ����Ӧ������Һ��OH����Ũ�ȡ� mol��L��1 ��
��3��ͨ������ȷ����Ʒ����ɣ�д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������Э����߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������У������������ʷ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����ظ߶���ѧ�����е��в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Ӧ�����������仯����ͼ��ʾ(ͼ��E1��ʾ����Ӧ�Ļ�ܣ�E2��ʾ�淴Ӧ�Ļ��)�������й�������ȷ����

A�������ܽ��ͷ�Ӧ�Ļ��
B�������ܸı䷴Ӧ���ʱ�(��H)
C���÷�ӦΪ���ȷ�Ӧ
D������Ӧ�Ļ��С���淴Ӧ�Ļ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����ظ߶���ѧ�����е��в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йع�ҵ������������ȷ����
A���ϳɰ���ҵ�У���NH3��ʱҺ�����������ڼӿ췴Ӧ����
B���ȼҵ�У�ʹ�����ӽ���Ĥ�ɷ�ֹC12��NaOH��Һ��Ӧ
C�����Ṥҵ�У��Ӵ����ڰ�װ�Ƚ���������Ϊ�����÷���¯���ų���SO2������
D�����Ṥҵ�У�SO2�Ĵ����������ø�ѹ������Ϊѹǿ��SO2ת������Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ���������и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
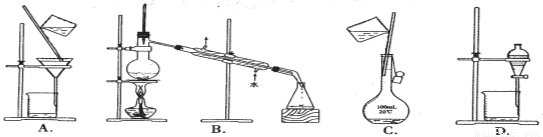
����ͼ��ʾװ�ý���ʵ�飬���ش��������⣺
��1���ж�װ�õ����ƣ�A��Ϊ ��B��Ϊ ��
��2��п��Ϊ �����缫��ӦʽΪ ��ͭ��Ϊ �����缫��ӦʽΪ ��ʯī��C1Ϊ �����缫��ӦʽΪ ��ʯī��C2����������ʵ������Ϊ ����Ӧ������B����Һ��pHֵ ��(����С�����䣬������������ˮ) ��
��3����C2������224 mL���壨��״���£���п������ �����ӻ���٣� g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ���������и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
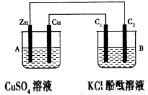
����ͼʾ�й���ͭ�缫�����Ӵ������
ͭпԭ��� ��⾫��ͭ �Ƽ��϶�ͭ ����Ȼ�ͭ��Һ
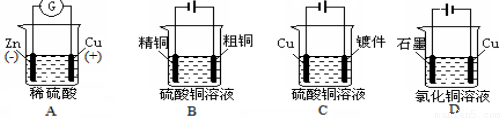
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�߶���ѧ��4�½β��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������´��ڷ�Ӧ:A(g)+B(g)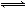 C(g)+D(g�� ��H��0������������ͬ��2 L���ݾ���(�����û����������)�ܱ�������,�ڢ��г���1 molA��1 mol B,�ڢ��г���1 mol C��1 mol D,�ڢ��г���2 mol A��2 mol B,500�������¿�ʼ��Ӧ���ﵽƽ��ʱ,����˵����ȷ����
C(g)+D(g�� ��H��0������������ͬ��2 L���ݾ���(�����û����������)�ܱ�������,�ڢ��г���1 molA��1 mol B,�ڢ��г���1 mol C��1 mol D,�ڢ��г���2 mol A��2 mol B,500�������¿�ʼ��Ӧ���ﵽƽ��ʱ,����˵����ȷ����
A��������������Ӧ������ͬ
B���������з�Ӧ��ƽ�ⳣ����ͬ
C����������A�����ʵ������������еĶ�
D����������A��ת��������������C��ת����֮��С��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������AG��ʾ��Һ����ȣ�AG�Ķ���Ϊ��AG=lg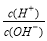 ��������ʵ������0.01 mol��L��1������������Һ�ζ�20 mL��ͬŨ�ȵĴ�����Һ���ζ���������ͼ��ʾ�������й�������ȷ���ǣ� ��
��������ʵ������0.01 mol��L��1������������Һ�ζ�20 mL��ͬŨ�ȵĴ�����Һ���ζ���������ͼ��ʾ�������й�������ȷ���ǣ� ��

A��A��ʱ��������������Һ���Ϊ20 mL
B������ʱ0.01 mol��L��1�Ĵ�����ҺpH=4
C��OA����Һ�У�c(CH3COO��)> c(CH3COOH)
D����B��ʱ����NaOH��Һ40 mL��������Һ�У�c(CH3COO��)+2 c(CH3COOH) = c(OH��) - c(H+)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com