
 氢气是一种高能燃料,也广范应用在工业合成中.
氢气是一种高能燃料,也广范应用在工业合成中.分析 (1)根据盖斯定律分析解答;
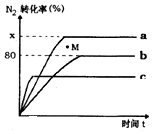
(2)①N2+3H2?2NH3△H<0,而恒容绝热容器中进行,所以体系温度最高,反应速率最快,达平衡的时间最短;
②平衡常数是温度的函数,温度不变K不变,而曲线a和曲线b的温度相同;
③b容器中M点,最终达平衡状态,所以氮气的转化率减小,平衡逆向移动,则v(正)小于v(逆);
(3)阴极发生还原反应,电极反应式为2NO2-+6e-+4H2O=N2↑+8OH-;阴极收集到1l.2LN2时,即物质的量为0.5mol,根据转移电子数相等,求消耗NH3的体积;
(4)①K<10-5化学反应不发生,再根据①Cu(OH)2(s)?Cu2++2OH- Ksp=2.2×10-20;②Cu2++4NH3•H2O?[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012,反应Cu(OH)2(s)+4NH3•H2O?[Cu(NH3)4]2++4H2O+2OH-,由①+②得到;
②氢氧化四氨合铜是强碱,加硫酸使Cu(OH)2(s)+2NH3•H2O+2NH4+?[Cu(NH3)4]2++4H2O平衡正向移动,而络离子要稳定存在必须在碱性条件下,所以观察络离子溶解,得到深蓝色的溶液;
解答 解:(1)①2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3116kJ•mol-1;②C(石墨,s+O2(g)=CO2(g)△H=-393.5kJ•mol-1;③2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ•mol-1;根据盖斯定律可知:△H=-$\frac{①}{2}$+2②+$\frac{3}{2}③$,即乙烷标准生成焓的热化学方程式:2C(石墨)+3H2(g)=C2H6(g)△H=-86.4kJ/mol,故答案为:2C(石墨)+3H2(g)=C2H6(g)△H=-86.4kJ/mol;
(2)①N2+3H2?2NH3△H<0,而恒容绝热容器中进行,所以体系温度最高,反应速率最快,达平衡的时间最短,而由图可知消耗时间最短的是c,故选:c;
②平衡常数是温度的函数,温度不变K不变,而曲线a和曲线b的温度相同,
N2 +3H2 ?2NH3,
初起:1mol 2.8mol 0
变化:0.8mol 2.4mol 1.6mol
平衡:0.2mol 0.4mol 1.6mol
所以Kb=$\frac{0.{8}^{2}}{0.{2}^{3}×0.1}$=800=Ka,故答案为:800;
③b容器中M点,最终达平衡状态,所以氮气的转化率减小,平衡逆向移动,则v(正)小于v(逆),故答案为:小于;
(3)阴极发生还原反应,电极反应式为2NO2-+6e-+4H2O=N2↑+8OH-;阴极收集到1l.2LN2时,即物质的量为0.5mol,转移电子数的物质的量为:3mol,所以消耗氨气的物质的量为:1mol,则标况下的体积为22.4L,
故答案为:2NO2-+6e-+4H2O=N2↑+8OH-;22.4L;
(4)①K<10-5化学反应不发生,再根据①Cu(OH)2(s)?Cu2++2OH- Ksp=2.2×10-20、②Cu2++4NH3•H2O?[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012,由①+②得到Cu(OH)2(s)+4NH3•H2O?[Cu(NH3)4]2++4H2O+2OH-,所以该反应的K=Ksp•Kβ=1.6×10-7<10-5,所以反应很难进行,
故答案为:该反应的K=Ksp•Kβ=1.6×10-7<10-5,所以反应很难进行;
②氢氧化四氨合铜是强碱,加硫酸使Cu(OH)2(s)+2NH3•H2O+2NH4+?[Cu(NH3)4]2++4H2O平衡正向移动,而络离子要稳定存在必须在碱性条件下,所以观察络离子溶解,得到深蓝色的溶液,
故答案为:固体溶解,得到深蓝色溶液;溶液中存在平衡Cu(OH)2(s)+2NH3•H2O+2NH4+?[Cu(NH3)4]2++4H2O,加入硫酸按固体增大了按根离子浓度,平衡正向移动.
点评 本题考查图象的分析、平衡常数的计算、电极反应式的书写和平衡的移动,综合性强,为高频考点,侧重考查学生综合运用能力及分析判断能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石和氯化钾的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ/mol:E反应物<E生成物 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)△H=+178.2 kJ/mol:E反应物<E生成物 | |
| C. | HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与W形成的化合物中只有共价键 | B. | X与Z形成的化合物中只有离子键 | ||
| C. | 元素的非金属性:X>R>W | D. | 简单离子的半径:W>R>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
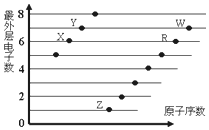
 X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Q位于第三周期IA族 | |
| B. | X、Y、Z三种元素组成的化合物可能是盐或碱 | |
| C. | 简单离子半径:M->Q+>R2+ | |
| D. | Z与M的最高价氧化物对应水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe2++3H2↑ | |
| B. | 碳酸氢钠与稀硫酸反应:HCO3-+H+═H2O+CO2↑ | |
| C. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液盛装在用玻璃塞的试剂瓶中 | |
| B. | 氢氟酸盛装在玻璃瓶中 | |
| C. | 金属钠保存在煤油中 | |
| D. | 硝酸银固体存放在细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③⑥ | B. | ④①②⑤③⑥ | C. | ⑤②④①③⑥ | D. | ⑤②④③①⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com