
分析 (1)根据公式n=$\frac{N}{{N}_{A}}$进行计算;
(2)一定温度与压强下,气体的体积之比等于物质的量之比,等于化学计量数之比,然后利用质量守恒定律来确定化学式;
(3)溶液中阴离子和阳离子的正负电荷守恒,根据守恒思想来计算.
解答 解:(1)6.02×1023个氢原子,即氢原子的物质的量是1mol,所以H2SO4的物质的量是0.5mol,故答案为:0.5mol;
(2)一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,设该化合物为Z,由气体的体积之比等于物质的量之比,等于化学计量数之比,
则X2+3Y2═2Z,由原子守恒可知,Z为XY3,故答案为:XY3或Y3X;
(3)溶液中阴离子和阳离子的正负电荷守恒,即n(Na+)+2n( Mg2+)=n (Cl-)+2n(SO42-),所以0.2 mol+2×0.25 mol=0.4 mol+2n(SO42-),解出n(SO42-)=0.15mol,故答案为:0.15mol.
点评 本题考查学生物质的量的有关计算知识,可以根据所学知识结合对计算公式的理解来回答,难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题

| 离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.8 | 10.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,则该溶液中一定含有SO42- | |
| B. | 用饱和NaHCO3溶液除去CO2气体中混有的少量SO2 | |
| C. | 将产生的气体依次通过足量的溴水和澄清石灰水,检验浓H2SO4与木炭反应生成的气体产物 | |
| D. | 实验室制取氢气,为了加快反应速率,可向稀硫酸中滴加少量Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
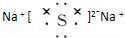 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 苹果酸在一定条件下能发生加成反应 | |
| D. | 苹果酸在一定条件下能发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com