
【题目】常温下用![]() 盐酸分别滴定
盐酸分别滴定![]() 浓度均为
浓度均为![]() 的NaOH溶液和二甲胺
的NaOH溶液和二甲胺![]() 溶液
溶液![]() 在水中电离方式与氨相似
在水中电离方式与氨相似![]() ,利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
,利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
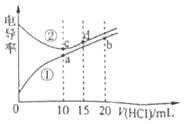
①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于1.0×10-7![]() 的是______,原因为______。
的是______,原因为______。
②化学反应往往伴有热效应,若为绝热体系,a的温度______![]() 填“
填“![]() ”,“
”,“![]() ”或“
”或“![]() ”
”![]() 点的温度。
点的温度。
【答案】a 此时恰好生成强酸弱碱盐,对水的电离有促进作用 ![]()
【解析】
①NaOH属于强碱,二甲胺的水溶液属于弱碱溶液,曲线①为滴定二甲胺溶液;强酸弱碱盐,对水的电离有促进作用;
②酸碱中和反应为放热反应,二甲胺的电离吸热,若为绝热体系a的温度<c点的温度。
①NaOH属于强碱,二甲胺的水溶液属于弱碱溶液,曲线①为滴定二甲胺溶液;碱或酸过量,会抑制水的电离,盐类水解促进水的电离,滴定终点前碱过量,滴定终点后酸过量,恰好完全滴定时形成盐,NaCl不会水解,而(CH3)2NH2+会水解,加入10mL盐酸时恰好完全反应,因此,a、b、c、d四点的溶液中,a点由水电离出氢离子浓度大于1.0×10-7molL-1;因为此时恰好生成强酸弱碱盐,对水的电离有促进作用,故答案为:a;此时恰好生成强酸弱碱盐,对水的电离有促进作用;
②酸碱中和反应为放热反应,二甲胺的电离过程吸热,若为绝热体系,则a的温度<c点的温度,故答案为:<。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 盐酸和氨水反应H++OH=H2O、B. 钠和冷水反应Na+2H2O=Na++2OH+H2↑
C. 氯气和氢氧化钠溶液反应Cl2+2OH=Cl+ClO+H2OD. 铜和稀硝酸反应Cu+2NO3+4H+=2Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学符号书写正确的是( )
A. 两个氢原子:H2 B. 镁的化合价+2价:Mg2+
C. 3个氧分子:3O2 D. 氯化钡的化学式:BaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
R-CH=CH2+H2O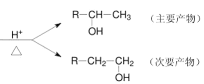
现以2-甲基丙烷为有机原料,配以其他必要的无机物原料,选择反应中的主要产物按以下流程合成产品:
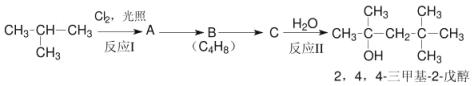
请回答:
(1)写出丙烯与氯化氢反应的主要产物的结构简式__________________;
(2)写出反应Ⅰ得到产物可能的结构简式__________________;
(3)写出反应类型:反应Ⅰ_________、反应Ⅱ_________;
(4)写出 A→B 的反应条件_____;B→C 的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
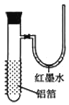
A.实验中发生的反应都是化合反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是


A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中有红色沉淀生成
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2O2中加入MnO2,产生O2的速度加快
C.合成氨为提高NH3的产率,理论上应采取高压低温的条件
D.氨水应密闭保存、放置于低温处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一也是国家的战略储备药物。也有专家尝试使用奥司他韦作为抗新型冠状病毒肺炎药物。下列说法正确的是( )

A.不能使酸性高锰酸钾溶液褪色
B.奥司他韦属于芳香族化合物
C.分子中所有碳原子共平面
D.可以发生加成反应、加聚反应、氧化反应、取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com