
【题目】请结合题中数据,写出对应的热化学方程式。
(1)16gCH3OH(l)与适量O2反应,生成CO2(g)和H2O(l),放出683.4kJ热量_____。
(2)N2(g)和H2(g)反应生成2 molNH3(g),放出92.2kJ热量_____。
(3)稀溶液中,1molH2SO4与NaOH完全反应时,放出114.6kJ热量,写出表示中和热的热化学方程式_______。
(4)agC(s)与足量O2反应生成CO2气体时,放出bkJ热量____。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=1366.8kJ·mol1 N2(g)+3H2(g)=2NH3(g) ΔH=92.2kJ·mol1
O2(g)=CO2(g)+2H2O(l) ΔH=1366.8kJ·mol1 N2(g)+3H2(g)=2NH3(g) ΔH=92.2kJ·mol1 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=57.3kJ·mol1 C(s)+O2(g)= CO2(g) ΔH=
Na2SO4(aq)+H2O(l) ΔH=57.3kJ·mol1 C(s)+O2(g)= CO2(g) ΔH=![]() kJ·mol1
kJ·mol1
【解析】
先写出相应反应的化学方程式,然后注明物质的存在状态,并在方程式后面注明与反应相应的能量变化。对于放热反应,反应热为负值,若为吸热反应,反应热为正值。中和热是强酸与强碱反应产生1mol水时放出的热量。
(1)16g CH3OH(l)的物质的量为n(CH3OH)=16g÷32g/mol=0.5mol,0.5mol甲醇完全氧化产生CO2气体和液态水放出热量为683.4kJ,则1mol液态甲醇发生氧化反应,放出热量为1366.8kJ,所以该反应的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=1366.8kJ·mol1;
O2(g)=CO2(g)+2H2O(l) ΔH=1366.8kJ·mol1;
(2) 1molN2(g)和3molH2(g)反应生成2 molNH3(g),放出92.2kJ热量,则该反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=92.2kJ·mol1;
(3)在稀溶液中,1molH2SO4与2molNaOH完全反应时,放出114.6kJ热量,则反应产生1mol水时放出热量是57.3kJ,所以表示中和热的热化学方程式为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=57.3kJ·mol1;
Na2SO4(aq)+H2O(l) ΔH=57.3kJ·mol1;
(1)agC(s)与足量O2反应生成CO2气体时,放出bkJ热量,则1molC完全燃烧产生CO2气体放出热量是Q=![]() ×bkJ,所以该反应的热化学方程式为:C(s)+O2(g)=CO2(g) ΔH=
×bkJ,所以该反应的热化学方程式为:C(s)+O2(g)=CO2(g) ΔH=![]() kJ·mol1。
kJ·mol1。


科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )
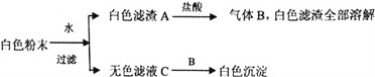
A.BaCl2、CaCO3一定存在,NaOH可能存在
B.K2SO4、CuSO4一定不存在
C.K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在
D.C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
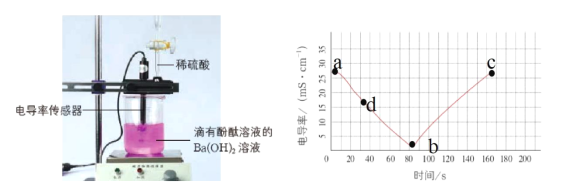
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
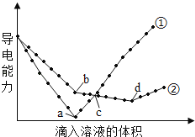
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如图所示(![]() N
N![]() O)。下列说法不正确的是( )
O)。下列说法不正确的是( )
![]()
A.NO属于极性分子
B.含有非极性共价键
C.过程②释放能量,过程③吸收能量
D.标准状况下,NO分解生成5.6LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
① W![]() X + H2O + CO2↑
X + H2O + CO2↑
② Z + CO2 → X + O2
③ Z + H2O → Y + O2↑
④ X + Ca(OH)2 → Y+ CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W_____________,X_____________,Y_____________,Z_____________。
(2)以上4个化学反应,属于氧化还原反应的是__________________________(填反应序号)。在反应③中氧化剂是___________________(写化学式),还原剂是_____________(写化学式),写出反应②化学方程式并双线桥法标出电子转移方向、数目_______________________________________。
(3)若④反应在溶液中进行,写出其离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)Cu+2Ag+=2Ag+Cu2+

(1)根据两反应本质,判断能否设计成原电池________________________________________。
(2)如果不能,说明其原因_______________________________________________________________。
(3)如果可以,则写出正、负极材料及其电极反应式和反应类型(“氧化反应“或“还原反应):
负极:___________,__________________________,__________;
正极:___________,__________________________,___________;
若导线上转移电子1mol,则正极质量增加_________g,电解质溶液是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ/mol
③H2O(l)= H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____。
(2)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=272.0kJ/mol
O2(g)=FeO(s) ΔH1=272.0kJ/mol
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=1675.7kJ/mol
O2(g)=Al2O3(s) ΔH2=1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是________。铝热反应的反应类型_____,某同学认为,铝热反应可用于工业炼铁,你的判断是_______(填“能”或“不能”),你的理由_________。
(3)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃、101kPa下:
①H2(g)+![]() O2(g)=H2O(g) ΔH1=242kJ/mol
O2(g)=H2O(g) ΔH1=242kJ/mol
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH2=676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com