
下列说法正确的是
A. 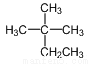 的系统命名为:2-甲基-2-乙基丙烷
的系统命名为:2-甲基-2-乙基丙烷
B. 在碱性条件下,CH3CO18OC2H5水解产物是CH3COOH和C2H518OH
C. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 以丙烯为单体加聚可以生成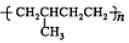
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列关于合金的叙述中正确的是( )
A. 日常生活中用到的五角硬币属于铜合金
B. 低碳钢比中碳钢强度高
C. 合金在任何情况都比单一金属性能优良
D. 合金是由两种或多种金属熔合而成的
查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:选择题
.在铁和氧化铁混合物15 g中,加入稀硫酸150 mL,能放出H21.68 L(标准状况)。同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化。为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3 mol·L-1的NaOH溶液200 mL,则原硫酸的物质的量浓度是
A. 1.5 mol·L-1 B. 2 mol·L-1 C. 2.5 mol·L-1 D. 3 mol·L-1
查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:选择题
下列化学用语正确的有
①乙酸的最简式:CH2O
②二氧化硅的分子式:SiO2
③HClO的结构式:H—Cl—O
④乙烯是结构简式:CH2CH2
⑤Cl-的结构示意图: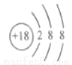
⑥过氧化钠的电子式:
⑦H2CO3的电离方程式:H2CO3 H++HCO3-
H++HCO3-
⑧吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三下学期第一次月考理科综合化学试卷(解析版) 题型:实验题
过氧化锶(SrO2)通常用作分析试剂、氧化剂、漂白剂等。制备反应原理为:Sr+O2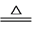 SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。
SrO2。某兴趣小组利用下列装置在实验室中模拟制备过氧化锶。
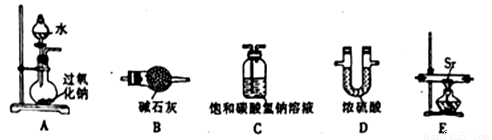
(1)选择必要仪器组装制备过氧化锶(气流按从左到右的流向):____________(填字母)。
(2)该实验制备氧气的化学方程式为______________。
(3)连接好装置并进行实验,实验步骤如下,实验操作顺序为___________(填字母)。
①打开分液漏斗活塞,将水滴入烧瓶②在相应装置中装入药品③检查装置气密性④加热
⑤停止加热⑥关闭分液漏斗活塞
(4)利用反应Sr2++H2O2+2NH3+8H2O=SrO2·8H2O↓+2NH4+,制备过氧化锶的装置如下:
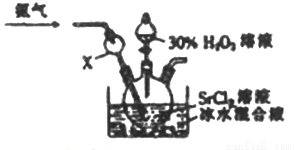
①X仪器的作用是_____________。
②氨气在该反应所起的作用是__________________。
③实验结束后,得到SrO2·8H2O的操作为_________________。
(5)设计实验证明SrO2的氧化性比FeCl3的氧化性强__________________。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三2月适应性考试(一)理综化学试卷(解析版) 题型:实验题
纳米ZnO的颗粒直径介于1~100nm之间,具有许多特殊的性能,可用于制造变阻器、图像记录材料、磁性材料和塑料薄膜等。一种利用粗ZnO(含FeO、Fe2O3、CuO)制备纳米ZnO的生产工艺流程如下图所示:
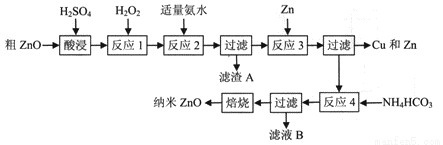
已知:① 生成氢氧化物沉淀时溶液的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有________(填写两种);
(2)反应1中发生反应的离子方程式为______________,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为_______mol/L;
(3)反应2中加适量氨水的目的是_________,此时所需pH的范围为_________,当调节溶液pH=5时,溶液中的c(Fe3+)=__________;
(4)反应3的离子方程式为__________,反应类型为__________;
(5)从滤液B中可回收的主要物质是__________;
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=_________。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三2月适应性考试(一)理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 向A12(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al(OH)3能溶于氨水 |
B | 将浓硫酸滴在胆矾晶体上 | 蓝色晶体变白 | 浓硫酸具有脱水性 |
C | 将新制的氯水滴在蓝色石蕊试纸上 | 试纸先变红后褪色 | Cl2有漂白性 |
D | 向某晶体的水溶液中加入2滴FeSO4溶液 | 产生特征蓝色沉淀 | 该晶体中一定含有[Fe(CN)6] 3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二上学期期末考试化学试卷(解析版) 题型:填空题
H2SO4是工业上常用的酸,NH4Al(SO4)2是一种食品加工业中常用的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_____________(用离子方程式说明)。
(2)20℃时,均为0.1mol L-1的几种电解质溶液的pH 随温度变化的曲线如图1 所示。
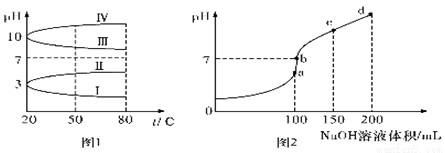
① 其中符合0.1mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是_______(填罗马数字)。
② 20℃ 时,0.1mol·L-1NH4Al(SO4)2溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____mol·L-1(填具体数字计算式,不必化简)
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol L-1NaOH溶液,溶液pH 与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d 四个点,水的电离程度最大的是__________点,在b点,溶液中各离子浓度由大到小的排列顺序是___________________。
(4)t℃ 时,pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶于,过滤、洗涤后将沉淀灼烧,得32g红棕色固体。根据题意下列结论不正确的是
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0mol·L-1 400ml,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com