
 ��
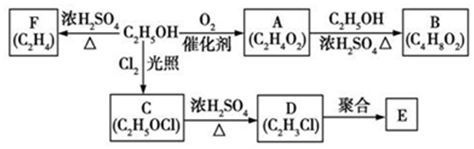
������ �Ҵ�����������A����A�ܺ��Ҵ���Ӧ������A�ķ���ʽ֪��AΪCH3COOH��A��Ũ���������������������·�����ȥ��Ӧ����F��FΪCH2=CH2���Ҵ��������ڹ��������·���ȡ����Ӧ����C��C��Ũ�����������������������ܷ�����ȥ��Ӧ����C�ṹ��ʽΪCH2ClCH2OH��DΪCH2=CHCl��D�����ۺϷ�Ӧ���ɾ�����ϩ��E�ṹ��ʽΪ ��A���Ҵ���Ũ���������������������·���������Ӧ����B��BΪCH3COOCH2CH3���Դ˽����⣮
��A���Ҵ���Ũ���������������������·���������Ӧ����B��BΪCH3COOCH2CH3���Դ˽����⣮
��� �⣺��1���Ҵ��ڹ��������·���ȡ����Ӧ����CH2ClCH2OH���ʴ�Ϊ��ȡ����Ӧ��
��2��DΪCH2=CHCl������̼̼˫�����ɷ����Ӿ۷�Ӧ������ʽΪnCH2=CHCl$\stackrel{һ������}{��}$ ��
��
�ʴ�Ϊ��nCH2=CHCl$\stackrel{һ������}{��}$ ��
��
��3��E������Ϊ-CH2-CHCl-������ʽ��Ϊ62.5����ۺ϶�Ϊ$\frac{625625}{62.5}$=10010���ʴ�Ϊ��10010��
��4��BΪCH3COOCH2CH3����Ӧ��ͬ���칹���ܷ���������Ӧ�������Ѽ���˵������ȩ������Ϊ��������Ҳ��Ϊ�ǻ�ȩ������Ϊ��������������������HOCH2CH2CH2CHO��CH3CHOHCH2CHO��CH3CH2CHOHCHO��CH3C��CH3��OHCHO��CH2OHCH��CH3��CHO����7�֣�
�ʴ�Ϊ��7��
���� ���⿼���л����ƶϣ����ؿ���ѧ�������ƶ��������漰�Ҵ�����ϩ��±���������ᡢ�����߷��ӻ�����֮���ת������ȷ�����л�������ż������ʡ������л���Ӧ���ͼ���Ӧ�������ɽ��ע���Ҵ���ȡ��ϩ������ƺ��¶ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
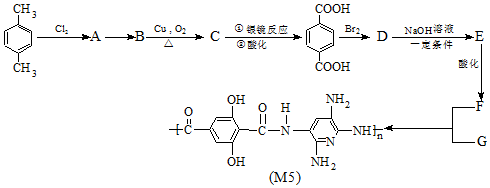
 ����״���ַ�Ӧ����Ӧ���л����������Ϊ���Ա������������
����״���ַ�Ӧ����Ӧ���л����������Ϊ���Ա������������ ��
�� ��
��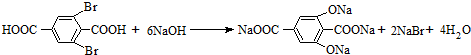 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6�� | B�� | 7�� | C�� | 8�� | D�� | 9�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4Cl�ĵ���ʽ��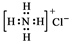 | B�� | Cl-�Ľṹʾ��ͼ��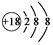 | ||
| C�� | �����ǵ�ʵ��ʽ��CH2O | D�� | ���������ӵĽṹ��ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
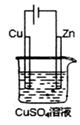 ��ͼ��һ��������ʾ��ͼ������ʹ��N2H4-����ȼ�ϵ����Ϊ�����̵ĵ�Դ��ͭƬ�����仯128g����N2H4һ����ȼ�ϵ�����������ı�״���µĿ�������������������������Ϊ20%��112L��
��ͼ��һ��������ʾ��ͼ������ʹ��N2H4-����ȼ�ϵ����Ϊ�����̵ĵ�Դ��ͭƬ�����仯128g����N2H4һ����ȼ�ϵ�����������ı�״���µĿ�������������������������Ϊ20%��112L���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
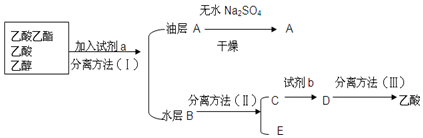
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com