
【题目】在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/L NaOH溶液进行滴定,则所需NaOH溶液的体积( )
A.大于20mL
B.小于20mL
C.等于20mL
D.等于5mL
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列仪器:①试管 ②坩埚 ③量筒 ④蒸发皿 ⑤烧瓶 ⑥集气瓶 ⑦烧杯 ⑧漏斗,可以用酒精灯直接加热的是
A. ①②③④⑤⑧ B. ①②④
C. ①③⑥⑦⑧ D. 都能直接加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题: 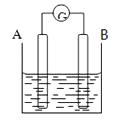
(1)若电流表的指针偏向B,则A为极,B为极
(2)若电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液
D.A是Ag,B是Fe,C是稀AgNO3溶液
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,则A,B的金属性强弱为
(4)任何一个自发的氧化还原反应都可以设计为原电池,若该电池中发生的反应为:Fe+2FeCl3═3FeCl2 , A电极为铁,则B电极为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于过滤和蒸发的说法错误的是
A.过滤时漏斗下端须紧靠烧杯内壁
B.过滤时滤纸边缘要低于漏斗边缘
C.蒸发时要用玻璃棒不断搅拌液体
D.蒸发时将液体全部蒸干后停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
I、CH4(g)═C(s)+2H2(g)△H=+75.0kJmol﹣1
II、CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJmol﹣1
III、CO(g)+H2(g)═C(s)+H2O(g)△H=﹣131.0kJmol﹣1
(1)反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H=kJmol﹣1 .
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲. 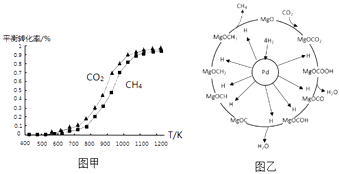
①同温度下CO2的平衡转化率(填“大于”或“小于”)CH4的平衡转化率,其原因是
②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是 .
(3)一定条件下Pd﹣Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为
(4)CO常用于工业冶炼金属,如图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.下列说法正确的是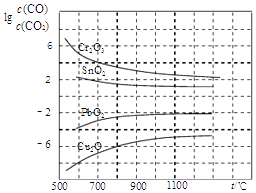
A.工业上可以通过增高反应装置来延长矿石和
CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于
提高CO的利用率
D.CO还原PbO2的反应△H>0
(5)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 ![]() 2CO+O2 , 则其阳极的电极反应式为 .
2CO+O2 , 则其阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是除去括号内杂质的有关操作,其中正确的是
A.苯(苯酚)——加浓溴水,振荡静置分液
B.NO(NO2)——通过水洗、干燥后,用向下排气法收集
C.乙烷(乙烯)——让气体通过盛饱和溴水的洗气瓶
D.乙醇(乙酸)——加足量NaOH溶液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示. 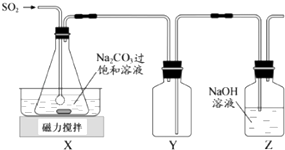
当溶液pH约为4时,停止反应.在20℃左右静置结晶.生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体.用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4 , 其可能的原因是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com