
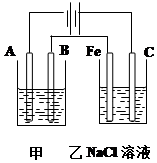
 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:分析 图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,C为阳极;
(1)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;乙池是电解饱和食盐水,总反应离子方程式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(2)甲池是精炼铜,增重12.8g是铜的质量,根据电解反应过程中电极上的电子守恒计算;
(3)依据析出铜的物质的量结合电子守恒计算生成的氢氧化钠的物质的量,来计算浓度.
解答 解:图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,C为阳极;
(1)依据电解原理精炼铜的装置是粗铜做阳极,精铜做阴极;含铜离子的溶液做电解质溶液;所以A极是阴极;材料是精铜;电极反应为:Cu2++2e-=Cu;B为阳极;材料是粗铜;电极反应主要为:Cu-2e-=Cu2+;电解质溶液是CuSO4溶液;乙池是电解饱和食盐水,总反应离子方程式为:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
故答案为:Cu2++2e-═Cu; Cu-2e-=Cu2+;2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(2)甲池是精炼铜,增重12.8g是铜的质量,物质的量为0.2mol,转移电子物质的量为0.4mol;根据电解反应过程中电极上的电子守恒计算可知;乙槽阳极电极反应为:2Cl--2e-=Cl2↑放出气体物质的量为0.2mol;在标准状况下的体积为4.48L;
故答案为:4.48L;
(3)依据析出铜的物质的量为0.2mol,电子转移为0.4mol,结合电子守恒和水电离出的氢离子和氢氧根离子守恒计算生成的氢氧化钠的物质的量来计算浓度;电极反应为:2H++2e-=H2↑;减少氢离子物质的量为0.4mol,溶液中增多氢氧根离子物质的量为0.4mol,常温下若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为1mol/L,故答案为:1mol•L-1.
点评 本题考查了电解池的工作原理的应用,电极判断方法,电极反应的书写,电子守恒的计算应用,串联的电解池,电极的分析判断,电路中电子守恒是解题关键.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA | |
| B. | 标准状况下,2.24 L NO和2.24 L O2混合后气体分子数为0.15NA | |
| C. | 通常状况下,3.36 L氯气与2.7 g铝充分反应转移的电子数等于0.3NA | |
| D. | 由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 漂白粉中加入浓盐酸:ClO-+Cl-+H2O═Cl2↑+2OH- | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:1 | B. | 3:3:1 | C. | 7:7:9 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中由水电离出的c(H+)为1.0×10-3mol/L | |
| B. | 在Na2A、NaHA两种溶液中,离子种类不同 | |
| C. | 在NaHA溶液中一定有c(OH-)+c(HA-)+2c(A2-)═c(Na+)+c(H+) | |
| D. | 在Na2A溶液中,c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com