
”¾ĢāÄæ”æĪķö²ÖŠŗ¬ÓŠ¶ąÖÖĪŪČ¾Īļ£¬°üĄØµŖŃõ»ÆĪļ![]() ”¢CO”¢
”¢CO”¢![]() µČ”£ĖüĆĒæÉŅŌĶعż»Æѧ·“Ó¦µĆµ½Ņ»¶ØµÄĻū³ż»ņ×Ŗ»Æ”£
µČ”£ĖüĆĒæÉŅŌĶعż»Æѧ·“Ó¦µĆµ½Ņ»¶ØµÄĻū³ż»ņ×Ŗ»Æ”£
![]() µŖĮņµÄŃõ»ÆĪļµÄ×Ŗ»Æ£ŗ
µŖĮņµÄŃõ»ÆĪļµÄ×Ŗ»Æ£ŗ ![]()
ŅŃÖŖ£ŗ![]()
![]()
![]() ,Ōņ
,Ōņ![]() _______
_______![]() ӣ
ӣ
Ņ»¶ØĢõ¼žĻĀ£¬½«![]() Óė
Óė![]() ŅŌŅ»¶Ø±ČĄżÖĆÓŚŗćĪĀŗćČŻµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ĻĀĮŠÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄÓŠ_______”£
ŅŌŅ»¶Ø±ČĄżÖĆÓŚŗćĪĀŗćČŻµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ĻĀĮŠÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄÓŠ_______”£
![]() »ģŗĻĘųĢåµÄĆÜ¶Č²»±ä
»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä ![]() »ģŗĻĘųĢåµÄŃÕÉ«±£³Ö²»±ä
»ģŗĻĘųĢåµÄŃÕÉ«±£³Ö²»±ä
![]() ŗĶNOµÄĢå»ż±Č±£³Ö²»±ä
ŗĶNOµÄĢå»ż±Č±£³Ö²»±ä ![]() ·“Ó¦ĖŁĀŹ
·“Ó¦ĖŁĀŹ![]()
![]() Ģ¼Ńõ»ÆĪļµÄ×Ŗ»Æ£ŗ
Ģ¼Ńõ»ÆĪļµÄ×Ŗ»Æ£ŗ
![]() æÉÓĆÓŚŗĻ³É¼×“¼£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
æÉÓĆÓŚŗĻ³É¼×“¼£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ![]() £¬ŌŚŅ»ŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė
£¬ŌŚŅ»ŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė![]() ŗĶ
ŗĶ![]() ½ųŠŠÉĻŹö·“Ó¦”£²āµĆCOŗĶ
½ųŠŠÉĻŹö·“Ó¦”£²āµĆCOŗĶ![]() ÅضČĖꏱ¼ä±ä»ÆČēĶ¼1ĖłŹ¾”£
ÅضČĖꏱ¼ä±ä»ÆČēĶ¼1ĖłŹ¾”£

Ōņ![]() ÄŚ£¬ĒāĘųµÄ·“Ó¦ĖŁĀŹĪŖ____
ÄŚ£¬ĒāĘųµÄ·“Ó¦ĖŁĀŹĪŖ____![]() µŚ
µŚ![]() ŗ󣬱£³ÖĪĀ¶Č²»±ä£¬ĻņøĆĆܱÕČŻĘ÷ÖŠŌŁ³äČė
ŗ󣬱£³ÖĪĀ¶Č²»±ä£¬ĻņøĆĆܱÕČŻĘ÷ÖŠŌŁ³äČė![]() ŗĶ
ŗĶ![]() £¬ŌņĘ½ŗā_______
£¬ŌņĘ½ŗā_______![]() Ģī”°ÕżĻņ”±”¢”°ÄęĻņ”±»ņ”°²»”±
Ģī”°ÕżĻņ”±”¢”°ÄęĻņ”±»ņ”°²»”±![]() ŅĘ¶Æ”£
ŅĘ¶Æ”£
![]() Ķعżµē½āCOÖʱø
Ķعżµē½āCOÖʱø![]() £¬µē½āŅŗĪŖĢ¼ĖįÄĘČÜŅŗ£¬¹¤×÷ŌĄķČēĶ¼2ĖłŹ¾£¬Š“³öŅõ¼«µÄµē¼«·“Ó¦Ź½_____”£ČōŅŌ¼×“¼Č¼ĮĻµē³Ų×÷ĪŖµēŌ“£¬ŌņÉś³É±ź×¼×“æöĻĀ
£¬µē½āŅŗĪŖĢ¼ĖįÄĘČÜŅŗ£¬¹¤×÷ŌĄķČēĶ¼2ĖłŹ¾£¬Š“³öŅõ¼«µÄµē¼«·“Ó¦Ź½_____”£ČōŅŌ¼×“¼Č¼ĮĻµē³Ų×÷ĪŖµēŌ“£¬ŌņÉś³É±ź×¼×“æöĻĀ![]() ŠčŅŖĻūŗÄ
ŠčŅŖĻūŗÄ![]() µÄÖŹĮæĪŖ_______”£
µÄÖŹĮæĪŖ_______”£

![]() ĮņŃõ»ÆĪļµÄ×Ŗ»Æ£ŗĮņµÄŃõ»ÆĪļÓėŅ»¶ØĮæ°±Ęų”¢æÕĘų·“Ó¦£¬æÉÉś³ÉĮņĖįļ§”£ĮņĖįļ§Ė®ČÜŅŗ³ŹĖįŠŌµÄŌŅņŹĒ________________
ĮņŃõ»ÆĪļµÄ×Ŗ»Æ£ŗĮņµÄŃõ»ÆĪļÓėŅ»¶ØĮæ°±Ęų”¢æÕĘų·“Ó¦£¬æÉÉś³ÉĮņĖįļ§”£ĮņĖįļ§Ė®ČÜŅŗ³ŹĖįŠŌµÄŌŅņŹĒ________________![]() ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾
ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾![]() ŹŅĪĀŹ±£¬Ļņ
ŹŅĪĀŹ±£¬Ļņ![]() ČÜŅŗÖŠµĪČėNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌ£¬ŌņĖłµĆČÜŅŗÖŠĪ¢Į£ÅØ¶Č“óŠ”¹ŲĻµ£ŗ
ČÜŅŗÖŠµĪČėNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌ£¬ŌņĖłµĆČÜŅŗÖŠĪ¢Į£ÅØ¶Č“óŠ”¹ŲĻµ£ŗ![]() ____
____![]() Ģī”°
Ģī”°![]() ”±”¢”°
”±”¢”°![]() ”±»ņ”°
”±»ņ”°![]() ”±
ӱ![]() ӣ
ӣ
”¾“š°ø”æ![]() b
b ![]() ÕżĻņ
ÕżĻņ ![]()
![]()
![]()
![]()
”¾½āĪö”æ
øł¾ŻøĒĖ¹¶ØĀɼ°ČČ»Æѧ·½³ĢŹ½ŹéŠ“¹ęŌņ¼ĘĖć·“Ó¦ČČ²¢ŹéŠ“ČČ»Æѧ·½³ĢŹ½£»øł¾Ż»ÆŃ§Ę½ŗāŌĄķ·ÖĪöŹĒ·ń“ļµ½»ÆŃ§Ę½ŗāדĢ¬£»øł¾ŻĢāøųŠÅĻ¢¼ĘĖć·“Ó¦ĖŁĀŹ£¬øł¾ŻQÓėKµÄĻą¶Ō“óŠ”ÅŠ¶ĻĘ½ŗāµÄŅĘ¶Æ·½Ļņ£»øł¾Żµē½āŌĄķ¼°µē¼«·“Ó¦Ź½½ųŠŠĻą¹Ų¼ĘĖć£»øł¾ŻĪļĮĻŹŲŗć¼°µēŗÉŹŲŗć±Č½ĻČÜŅŗÖŠµÄĄė×ÓÅØ¶Č“óŠ””£
![]() ÓÉøĒĖ¹¶ØĀÉæÉÖŖ£¬
ÓÉøĒĖ¹¶ØĀÉæÉÖŖ£¬![]() µĆ³ö·“Ó¦
µĆ³ö·“Ó¦![]() £¬ĖłŅŌ
£¬ĖłŅŌ![]() £¬
£¬
![]() ·“Ó¦ĢåĻµµÄĢå»żŗĶÖŹĮ涼²»±ä£¬ĖłŅŌ»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
·“Ó¦ĢåĻµµÄĢå»żŗĶÖŹĮ涼²»±ä£¬ĖłŅŌ»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
![]() ŃÕÉ«µÄÉīĒ³Óė
ŃÕÉ«µÄÉīĒ³Óė![]() µÄÅضČÓŠ¹ŲĻµ£¬ĖłŅŌµ±»ģŗĻĘųĢåµÄŃÕÉ«±£³Ö²»±äŹ±£¬ŌņĖµĆ÷
µÄÅضČÓŠ¹ŲĻµ£¬ĖłŅŌµ±»ģŗĻĘųĢåµÄŃÕÉ«±£³Ö²»±äŹ±£¬ŌņĖµĆ÷![]() µÄÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬Ņņ“Ė·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
µÄÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬Ņņ“Ė·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
![]() Čō
Čō![]() ŗĶNOŅŌĪļÖŹµÄĮæÖ®±Č
ŗĶNOŅŌĪļÖŹµÄĮæÖ®±Č![]() ³äČėČŻĘ÷ÖŠ£¬ĪŽĀŪŹĒ·ń“ļµ½Ę½ŗāדĢ¬£¬
³äČėČŻĘ÷ÖŠ£¬ĪŽĀŪŹĒ·ń“ļµ½Ę½ŗāדĢ¬£¬![]() ŗĶNOµÄĢå»ż±ČŹ¼ÖÕ±£³Ö²»±ä£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
ŗĶNOµÄĢå»ż±ČŹ¼ÖÕ±£³Ö²»±ä£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£»
![]() ĪŽĀŪŹĒ·ń“ļµ½Ę½ŗāדĢ¬£¬»Æѧ·“Ó¦ĖŁĀŹÖ®±Č¶¼µČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£»¹Ź“š°øĪŖ£ŗ
ĪŽĀŪŹĒ·ń“ļµ½Ę½ŗāדĢ¬£¬»Æѧ·“Ó¦ĖŁĀŹÖ®±Č¶¼µČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬£»¹Ź“š°øĪŖ£ŗ![]() £»b£»
£»b£»
![]() ¢ŁÉś³É
¢ŁÉś³É![]() ¼×“¼£¬ŠčŅŖĻūŗÄ
¼×“¼£¬ŠčŅŖĻūŗÄ![]() ĒāĘų£¬ĖłŅŌĒ°4minÄŚ
ĒāĘų£¬ĖłŅŌĒ°4minÄŚ![]() £»
£»![]() £¬4minŗ󣬱£³ÖĪĀ¶Č²»±ä£¬ĻņøƱÕČŻĘ÷ÖŠŌŁ³äČė
£¬4minŗ󣬱£³ÖĪĀ¶Č²»±ä£¬ĻņøƱÕČŻĘ÷ÖŠŌŁ³äČė![]() ŗĶ
ŗĶ![]() £¬
£¬![]() £¬ĖłŅŌ·“Ó¦ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬¹Ź“š°øĪŖ£ŗ
£¬ĖłŅŌ·“Ó¦ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬¹Ź“š°øĪŖ£ŗ![]() £»ÕżĻņ£»
£»ÕżĻņ£»
¢Śµē½āŌĄķæÉÖŖ£¬Ńō¼«Ź§Č„µē×ÓÉś³É¶žŃõ»ÆĢ¼ĘųĢ壬¼ÓČėĢ¼ĖįÄĘ£¬Ģ¼ĖįÄĘÓė¶žŃõ»ÆĢ¼·“Ӧɜ³ÉĢ¼ĖįĒāÄĘ£¬Ņõ¼«COµĆµ½µē×ÓÉś³É¼×ĶéĘųĢ壬¾Ż“ĖĄė×Ó·“Ó¦·½³ĢŹ½ĪŖ£ŗ![]() £¬Ņõ¼«Ēųµē¼«·“Ó¦Ź½ĪŖ
£¬Ņõ¼«Ēųµē¼«·“Ó¦Ź½ĪŖ![]() £»µē½āCOÖʱø
£»µē½āCOÖʱø![]() £¬CŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ
£¬CŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ![]() ¼Ū½µµĶµ½
¼Ū½µµĶµ½![]() ¼Ū£¬·¢Éś»¹Ō·“Ó¦£¬µē½āÖŹĪŖĢ¼ĖįÄĘČÜŅŗ£¬ŌņŅõ¼«Ēųµē¼«·“Ó¦Ź½ĪŖ
¼Ū£¬·¢Éś»¹Ō·“Ó¦£¬µē½āÖŹĪŖĢ¼ĖįÄĘČÜŅŗ£¬ŌņŅõ¼«Ēųµē¼«·“Ó¦Ź½ĪŖ![]() £»¼×“¼Č¼ĮĻµē³ŲÖŠ£¬ĆæĻūŗÄ
£»¼×“¼Č¼ĮĻµē³ŲÖŠ£¬ĆæĻūŗÄ![]() £¬×ŖŅĘ
£¬×ŖŅĘ![]() £¬±ź×¼×“æöĻĀ£¬
£¬±ź×¼×“æöĻĀ£¬![]() µÄĪļÖŹµÄĮæĪŖ
µÄĪļÖŹµÄĮæĪŖ![]() £¬Éś³É
£¬Éś³É![]() ×ŖŅʵĵē×ÓŹżĪŖ
×ŖŅʵĵē×ÓŹżĪŖ![]() £¬ŌņŠčŅŖ¼×“¼ĪŖ
£¬ŌņŠčŅŖ¼×“¼ĪŖ![]() £¬ÖŹĮæĪŖ
£¬ÖŹĮæĪŖ![]() £»¹Ź“š°øĪŖ£ŗ
£»¹Ź“š°øĪŖ£ŗ![]() £»
£»![]() £»
£»
![]() ĮņĖįļ§ŹĒĒæĖįČõ¼īŃĪ£¬ĘäĖ®ČÜŅŗ³ŹĖįŠŌµÄŌŅņŹĒ
ĮņĖįļ§ŹĒĒæĖįČõ¼īŃĪ£¬ĘäĖ®ČÜŅŗ³ŹĖįŠŌµÄŌŅņŹĒ![]() Ė®½āŹ¹ČÜŅŗĻŌĖįŠŌ£ŗ
Ė®½āŹ¹ČÜŅŗĻŌĖįŠŌ£ŗ![]() £»ŹŅĪĀŹ±£¬Ļņ
£»ŹŅĪĀŹ±£¬Ļņ![]() ČÜŅŗÖŠµĪČėNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌ£¬øł¾ŻµēŗÉŹŲŗć£¬
ČÜŅŗÖŠµĪČėNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌ£¬øł¾ŻµēŗÉŹŲŗć£¬![]() £¬ÖŠŠŌČÜŅŗÖŠ
£¬ÖŠŠŌČÜŅŗÖŠ![]() £¬ĪļĮĻŹŲŗćĪŖ
£¬ĪļĮĻŹŲŗćĪŖ![]() £¬ŌņĖłµĆČÜŅŗÖŠ
£¬ŌņĖłµĆČÜŅŗÖŠ![]() £»¹Ź“š°øĪŖ£ŗ
£»¹Ź“š°øĪŖ£ŗ![]() £»
£»![]() ”£
ӣ


 ŠĀĖ¼Ī¬¼ŁĘŚ×÷Ņµŗ®¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
ŠĀĖ¼Ī¬¼ŁĘŚ×÷Ņµŗ®¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠĖȤŠ”×éµÄĶ¬Ń§ÓĆĻĀĶ¼ĖłŹ¾×°ÖĆŃŠ¾æÓŠ¹Ųµē»ÆѧµÄĪŹĢā”£µ±±ÕŗĻøĆ×°ÖƵĵē¼üŹ±£¬¹Ū²ģµ½¼ģĮ÷¼ĘµÄÖøÕė·¢ÉśĮĖĘ«×Ŗ”£
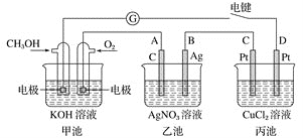
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©¼×³ŲĪŖ________(Ģī”°Ōµē³Ų”±”¢”°µē½ā³Ų”±»ņ”°µē¶Ę³Ų”±)£¬ĶØČėCH3OHŅ»¼«µÄµē¼«·“Ó¦Ź½ĪŖ_____________________________________________________________£»
£Ø2£©ŅŅ³ŲÖŠA(ŹÆÄ«)µē¼«µÄĆū³ĘĪŖ________(Ģī”°Õż¼«”±”¢”°øŗ¼«”±”¢”°Ņõ¼«”±»ņ”°Ńō¼«”±)£¬×Ü·“Ó¦Ź½ĪŖ_________________________________________________________£»
£Ø3£©µ±ŅŅ³ŲÖŠB¼«ÖŹĮæŌö¼Ó5.40 gŹ±£¬¼×³ŲÖŠĄķĀŪÉĻĻūŗÄO2µÄĢå»żĪŖ________ mL(±ź×¼×“æö)£¬±ū³ŲÖŠ________¼«Īö³ö________ gĶ£»
£Ø4£©Čō±ūÖŠµē¼«²»±ä£¬½«ĘäČÜŅŗ»»³ÉNaClČÜŅŗ£¬µē¼ü±ÕŗĻŅ»¶ĪŹ±¼äŗ󣬼×ÖŠČÜŅŗµÄpH½«________(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)£»±ūÖŠČÜŅŗµÄpH½«________(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬ČŻĘ÷ÄŚÄ³Ņ»·“Ó¦ÖŠM”¢NµÄĪļÖŹµÄĮæĖę·“Ó¦Ź±¼ä±ä»ÆµÄĒśĻßČēĶ¼£¬ĻĀĮŠ±ķŹöÕżČ·µÄŹĒ£Ø £©
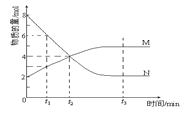
A.·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ2M![]() N
N
B.t2Ź±£¬Õż”¢Äę·“Ó¦ĖŁĀŹĻąµČ£¬“ļµ½Ę½ŗā
C.t3Ź±£¬Õż·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ
D.t1Ź±NµÄÅØ¶ČŹĒMÅØ¶ČµÄ2±¶
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆCO2Éś²śČ¼ĮĻ¼×“¼(CH3OH)”£ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)£¬Ķ¼1±ķŹ¾øĆ·“Ó¦¹ż³ĢÖŠÄÜĮæ(µ„Ī»ĪŖkJ”¤mol-1)µÄ±ä»Æ”£
CH3OH(g)+H2O(g)£¬Ķ¼1±ķŹ¾øĆ·“Ó¦¹ż³ĢÖŠÄÜĮæ(µ„Ī»ĪŖkJ”¤mol-1)µÄ±ä»Æ”£

(1)øĆ·“Ó¦ĪŖ___(ĢīĪüČČ»ņ·ÅČČ)·“Ó¦”£
(2)ŌŚĢå»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬ĻĀĮŠÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ___(ĢīŠņŗÅ)”£
A.v(H2)=3v(CO2)
B.ČŻĘ÷ÄŚĘųĢåŃ¹Ēæ±£³Ö²»±ä
C.vÄę(CO2)=vÕż(CH3OH)
D.ČŻĘ÷ÄŚĘųĢåĆܶȱ£³Ö²»±ä
E.2molC=O¼ü¶ĻĮѵÄĶ¬Ź±CH3OHÖŠÓŠ1molH”ŖO¼üŠĪ³É
F.»ģŗĻĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæ²»±ä
(3)ŌŚĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė1molCO2ŗĶ3molH2£¬²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼2ĖłŹ¾”£“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ÓĆĒāĘųÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(H2)=___”£“ļĘ½ŗāŹ±ČŻĘ÷ÄŚĘ½ŗāŹ±ÓėĘšŹ¼Ź±µÄŃ¹Ēæ±Č___”£
(4)¼×“¼”¢ŃõĘųŌŚŅ»¶ØĢõ¼žĻĀæɹ¹³ÉČēĶ¼3ĖłŹ¾µÄČ¼ĮĻµē³Ų£¬Ęäøŗ¼«µÄµē¼«·“Ó¦ĪŖ___£¬ÓėĒ¦Šīµē³ŲĻą±Č£¬µ±ĻūŗÄĻąĶ¬ÖŹĮæµÄøŗ¼«ĪļÖŹŹ±£¬¼×“¼Č¼ĮĻµē³ŲµÄĄķĀŪ·ÅµēĮæŹĒĒ¦Šīµē³ŲµÄ___±¶(±£ĮōŠ”Źżµćŗó1Ī»)”£
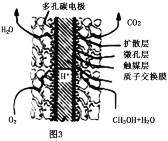
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×“¼ÓÖ³Ę”°Ä¾“¼”±£¬ŹĒĪŽÉ«ÓŠ¾Ę¾«ĘųĪ¶Ņ×»Ó·¢µÄÓŠ¶¾ŅŗĢ唣¼×“¼ŹĒÖŲŅŖµÄ»Æѧ¹¤Ņµ»ł“”ŌĮĻŗĶŅŗĢåČ¼ĮĻ£¬æÉÓĆÓŚÖĘŌģ¼×Č©ŗĶÅ©Ņ©£¬²¢³£ÓĆ×÷ÓŠ»śĪļµÄŻĶČ”¼ĮŗĶ¾Ę¾«µÄ±äŠŌ¼ĮµČ”£
£Ø1£©¹¤ŅµÉĻæÉĄūÓĆCO2ŗĶH2Éś²ś¼×“¼£¬·½³ĢŹ½ČēĻĀ£ŗ
CO2£Øg£©£«3H2£Øg£©![]() CH3OH£Øl£©£«H2O £Øg£© ”÷H£½Q1kJ”¤mol£1
CH3OH£Øl£©£«H2O £Øg£© ”÷H£½Q1kJ”¤mol£1
ÓÖ²é׏ĮĻµĆÖŖ£ŗ¢ŁCH3OH£Øl£©£«1/2 O2£Øg£©![]() CO2£Øg£©£«2H2£Øg£© ”÷H£½Q2kJ”¤mol£1
CO2£Øg£©£«2H2£Øg£© ”÷H£½Q2kJ”¤mol£1
¢ŚH2O£Øg£©=H2O£Øl£© ”÷H= Q3kJ”¤mol£1£¬Ōņ±ķŹ¾¼×“¼µÄČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ______”£
ijĶ¬Ń§Éč¼ĘĮĖŅ»øö¼×“¼Č¼ĮĻµē³Ų£¬²¢ÓĆøƵē³Ųµē½ā200mLŅ»¶ØÅØ¶ČµÄNaClÓėCuSO4»ģŗĻČÜŅŗ£¬Ęä×°ÖĆČēĶ¼£ŗ
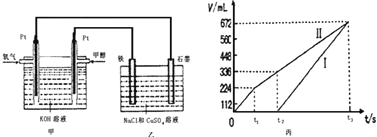
£Ø2£©ĪŖ³żČ„±„ŗĶŹ³ŃĪĖ®ÖŠµÄļ§øłĄė×Ó£¬æÉŌŚ¼īŠŌĢõ¼žĻĀĶØČėĀČĘų£¬·“Ӧɜ³ÉµŖĘų”£øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________________________________”£
£Ø3£©¹żĮæĀČĘųÓĆNa2S2O3³żČ„£¬·“Ó¦ÖŠS2O32-±»Ńõ»ÆĪŖSO42-”£Čō¹żĮæµÄĀČĘųĪŖ1”Į10-3mol£¬ŌņĄķĀŪÉĻÉś³ÉµÄSO42-ĪŖ_____________mol”£
£Ø4£©Š“³ö¼×ÖŠĶØČė¼×“¼ÕāŅ»¼«µÄµē¼«·“Ó¦Ź½______________________”£
£Ø5£©ĄķĀŪÉĻŅŅÖŠĮ½¼«ĖłµĆĘųĢåµÄĢå»żĖꏱ¼ä±ä»ÆµÄ¹ŲĻµČē±ūĶ¼ĖłŹ¾£ØŅŃ»»Ėć³É±ź×¼×“æöĻĀµÄĢå»ż£©£¬Š“³öŌŚt1ŗó£¬ŹÆÄ«µē¼«ÉĻµÄµē¼«·“Ó¦Ź½____________£¬Ō»ģŗĻČÜŅŗÖŠ NaClµÄĪļÖŹµÄĮæÅضČĪŖ___________mol/L”££ØÉčČÜŅŗĢå»ż²»±ä£©
£Ø6£©µ±ĻņÉĻŹö¼××°ÖĆÖŠĶØČė±źæöĻĀµÄŃõĘų336mLŹ±£¬ĄķĀŪÉĻŌŚĢśµē¼«ÉĻæÉĪö³öĶµÄÖŹĮæĪŖ_____________g”£
£Ø7£©ČōŹ¹ÉĻŹöµē½ā×°ÖƵĵēĮ÷Ēæ¶Č“ļµ½5£®0A£¬ĄķĀŪÉĻĆæ·ÖÖÓÓ¦Ļņøŗ¼«ĶØČėĘųĢåµÄÖŹĮæĪŖ_____________æĖ”££ØŅŃÖŖ1øöµē×ÓĖł“ųµēĮæĪŖ1£®6”Į10-19C£¬¼ĘĖć½į¹ū±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æėĀ![]() ÓÖ³ĘĮŖ°±£¬ŹĒŅ»ÖÖæÉČ¼ŠŌµÄŅŗĢ壬æÉÓĆ×÷»š¼żČ¼ĮĻ”£
ÓÖ³ĘĮŖ°±£¬ŹĒŅ»ÖÖæÉČ¼ŠŌµÄŅŗĢ壬æÉÓĆ×÷»š¼żČ¼ĮĻ”£
![]() ŅŃÖŖŌŚ101kPaŹ±£¬
ŅŃÖŖŌŚ101kPaŹ±£¬![]() Ź±£¬
Ź±£¬![]() ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉµŖĘųŗĶĖ®£¬·Å³ö624kJµÄČČĮ棬Ōņ
ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉµŖĘųŗĶĖ®£¬·Å³ö624kJµÄČČĮ棬Ōņ![]() µÄČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ŹĒ_____________”£
µÄČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ŹĒ_____________”£
![]() ĻĀĶ¼ŹĒŅ»øöµē»Æѧ¹ż³ĢŹ¾ŅāĶ¼”£
ĻĀĶ¼ŹĒŅ»øöµē»Æѧ¹ż³ĢŹ¾ŅāĶ¼”£

![]() Ķ¼ÖŠ¼×³ŲŹĒ_________
Ķ¼ÖŠ¼×³ŲŹĒ_________![]() Ģī”°Ōµē³Ų”±»ņ”°µē½ā³Ų”±
Ģī”°Ōµē³Ų”±»ņ”°µē½ā³Ų”±![]() £¬Ęäµē½āÖŹČÜŅŗĪŖKOHČÜŅŗ£¬ŌņøĆ³Ųµē¼«MµÄµē¼«·“Ó¦Ź½ŹĒ_________________________”£
£¬Ęäµē½āÖŹČÜŅŗĪŖKOHČÜŅŗ£¬ŌņøĆ³Ųµē¼«MµÄµē¼«·“Ó¦Ź½ŹĒ_________________________”£
![]() ŅŅ³ŲÖŠŹÆÄ«µē¼«2µÄµē¼«·“Ó¦Ź½ŹĒ_________________________”£ µ±ŹÆÄ«µē¼«2ÉĻÉś³É
ŅŅ³ŲÖŠŹÆÄ«µē¼«2µÄµē¼«·“Ó¦Ź½ŹĒ_________________________”£ µ±ŹÆÄ«µē¼«2ÉĻÉś³É![]() ĘųĢåŹ±
ĘųĢåŹ±![]() ±ź×¼×“æöĻĀ
±ź×¼×“æöĻĀ![]() £¬×ŖŅʵĵē×ӵďżÄæĪŖ_________£¬Ōņ¼×³ŲĄķĀŪÉĻĻūŗıź±ź×¼×“æöĻĀµÄæÕĘųŹĒ________
£¬×ŖŅʵĵē×ӵďżÄæĪŖ_________£¬Ōņ¼×³ŲĄķĀŪÉĻĻūŗıź±ź×¼×“æöĻĀµÄæÕĘųŹĒ________![]() ¼ŁÉčæÕĘųÖŠŃõĘųĢå»żŗ¬ĮæĪŖ
¼ŁÉčæÕĘųÖŠŃõĘųĢå»żŗ¬ĮæĪŖ![]() ”£
ӣ
![]() “«Ķ³ÖʱøėĀµÄ·½·Ø£¬ŹĒŅŌNaClOŃõ»Æ
“«Ķ³ÖʱøėĀµÄ·½·Ø£¬ŹĒŅŌNaClOŃõ»Æ![]() £¬ÖʵĆėĀµÄĻ”ČÜŅŗ”£øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ_________”£
£¬ÖʵĆėĀµÄĻ”ČÜŅŗ”£øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ_________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČ¼ĮĻµē³Ų¾ßÓŠ¹ćĄ«µÄ·¢Õ¹Ē°Ķ¾£¬æĘѧ¼Ņ½üğъÖĘ³öŅ»ÖÖĪ¢ŠĶµÄČ¼ĮĻµē³Ų£¬²ÉÓĆ¼×“¼Č”“śĒāĘų×öČ¼ĮĻæÉŅŌ¼ņ»Æµē³ŲÉč¼Ę£¬øƵē³ŲÓŠĶūČ”“ś“«Ķ³µē³Ų”£Ä³Ń§ÉśŌŚŹµŃéŹŅĄūÓĆ¼īŠŌ¼×“¼Č¼ĮĻµē³Ųµē½āNa2SO4ČÜŅŗ”£
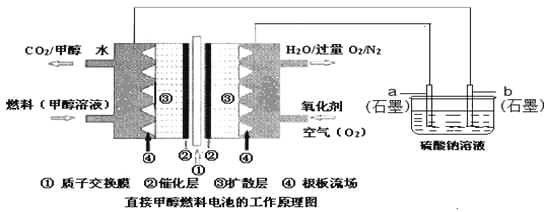
Ēėøł¾ŻĶ¼Ź¾»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ķ¼ÖŠaµē¼«ŹĒ______£ØĢī”°Õż¼«”±”¢”°øŗ¼«”±”¢”°Ņõ¼«”±»ņ”°Ńō¼«”±£©”£øƵē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦Ź½ĪŖ_________________________________________”£
£Ø2£©¼īŠŌĢõ¼žĻĀ£¬ĶØČė¼×“¼µÄŅ»¼«·¢ÉśµÄµē¼«·“Ó¦Ź½ĪŖ____________________________”£
£Ø3£©µ±ĻūŗÄ3.36 LŃõĘųŹ±£ØŅŃÕŪŗĻĪŖ±ź×¼×“æö£©£¬ĄķĀŪÉĻµē½āNa2SO4ČÜŅŗÉś³ÉĘųĢåµÄ×ÜĪļÖŹµÄĮæŹĒ__”£
£Ø4£©25”ę”¢101kPaŹ±£¬Č¼ÉÕ16g¼×“¼Éś³ÉCO2ŗĶH2O(l)£¬·Å³öµÄČČĮæĪŖ363.26kJ£¬Š“³ö¼×“¼Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½£ŗ_________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖBaSO4£Øs£©![]() Ba2+£Øaq£©+SO42©£Øaq£©£¬25”ꏱKsp=1.07”Į10©10£¬ĒŅBaSO4µÄČܽā¶ČĖęĪĀ¶ČÉżø߶ųŌö“ó£®ČēĶ¼ĖłŹ¾£¬ÓŠT1”¢T2²»Ķ¬ĪĀ¶ČĻĀĮ½ĢõBaSO4ŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻߣ¬ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
Ba2+£Øaq£©+SO42©£Øaq£©£¬25”ꏱKsp=1.07”Į10©10£¬ĒŅBaSO4µÄČܽā¶ČĖęĪĀ¶ČÉżø߶ųŌö“ó£®ČēĶ¼ĖłŹ¾£¬ÓŠT1”¢T2²»Ķ¬ĪĀ¶ČĻĀĮ½ĢõBaSO4ŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻߣ¬ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
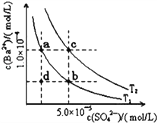
A. ĪĀ¶ČĪŖT1Ź±£¬ŌŚT1ĒśĻßÉĻ·½ĒųÓņČĪŅāŅ»µćŹ±£¬¾łÓŠBaSO4³ĮµķÉś³É
B. Õō·¢ČܼĮæÉÄÜŹ¹ČÜŅŗÓÉdµć±äĪŖT1ĒśĻßÉĻa”¢bÖ®¼äµÄijŅ»µć
C. ÉżĪĀæÉŹ¹ČÜŅŗÓÉbµć±äĪŖdµć
D. T2£¾25”ę
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com