
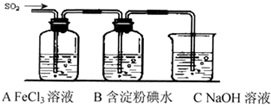
(6分)实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平)KClO3+HCl——HCl+Cl2↑+H2O
(1)配平上述反应化学方程式:
KClO3+ HCl—— KCl+ Cl2↑+ H2O
(2)若产生0.1mol Cl2,则转移电子的物质的量为 mol。
(3)若反应中HCl的的利用率只有50%,当氧化产物比还原子能产物多7.1g时,求浓盐
酸的物质的量浓度。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:
(2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下: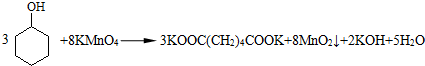
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com