
| A. | $\frac{1}{14}$mol/L | B. | $\frac{4}{5}$mol/L | C. | $\frac{1}{28}$mol/L | D. | $\frac{1}{42}$mol/L |
分析 NO2和O2按体积比4:1混合后充入一干燥烧瓶中,把烧瓶倒置于水中发生4NO2+O2+2H2O=4HNO3,水充满烧瓶,结合反应及c=$\frac{n}{V}$计算.
解答 解:设混合气体中含有4VLNO2,1VLO2,则烧瓶的体积为5VL,
4NO2 +O2 +2H2O=4HNO3
$\frac{4V}{22.4}$mol $\frac{V}{22.4}$mol $\frac{4V}{22.4}$mol
则硝酸的物质的量为 $\frac{4V}{22.4}$mol,水充满烧瓶,溶液体积为5V,
则c(HNO3)=$\frac{\frac{4V}{22.4}mol}{5VL}$=$\frac{1}{28}$mol/L,
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意溶液体积的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4?2H++SO42- | B. | H2CO3?2H++CO32- | ||
| C. | CH3COOH?H++CH3COO- | D. | NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>Cl>P | B. | 非金属性:Cl>S>As | ||
| C. | 热稳定性:HCl>AsH3>PH3 | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| B. | 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,H2的燃烧热为571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,含1molNaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑥⑦ | C. | ③⑤⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
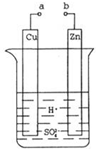 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com