
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B、加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C、c(Fe3+)=0.1mol?L-1的溶液:H+、Al3+、I-、SCN- |
| D、常温下pH=12的溶液:Na+、K+、SiO32-、NO3- |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流计的指针发生了偏转.
某兴趣小组的同学用如图所示装置研究有关电化学的问题,当闭合该装置的电键时,观察到电流计的指针发生了偏转. 查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中氧化剂得电子,化合价升高 |
| B、氧化还原反应中,一种物质被氧化,另一种物质必然被还原 |
| C、元素化合价没有升降的反应,一定是非氧化还原反应 |
| D、氧化还原反应都是有单质参加的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量SO2气体通入氨水中:SO2+NH3?H2O═NH4++HSO3- |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-═NO3-+H2O |
| D、向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做化学实验时产生的废液应倒入废液缸里 |
| B、熄灭酒精灯时,用嘴吹灭 |
| C、炒菜时油锅着火,立即盖上锅盖 |
| D、误食重金属盐,应喝豆浆、牛奶或鸡蛋清等解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
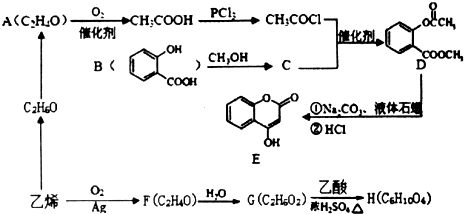
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com