
分析 (1)氧化铝、氧化铁与稀硫酸反应生成硫酸铝、硫酸铁,二氧化硅不反应,据此判断滤液a中阳离子组成;
(2)向滤液b中通入足量CO2,充分反应后过滤、洗涤,得Al(OH)3沉淀和碳酸氢钠;
(3)需要得到干燥的氢氧化铝的质量,所以需要干燥氢氧化铝,然后称量氢氧化铝沉淀的质量;
(4)要测定氧化铝的质量分数,需要知道样品总质量、氢氧化铝的质量,利用质量守恒写出铝土矿样品中Al2O3质量分数表达式.
解答 解:(1)将铝土矿样品粉碎后加入足量稀H2SO4溶液,Al2O3和Fe2O3与稀硫酸反应,SiO2不与稀硫酸反应,所以过滤后得到滤液a中含有阳离子为:H+、Al3+、Fe3+;
故答案为:H+、Al3+、Fe3+;
(2)向滤液b中通入足量CO2,充分反应后过滤、洗涤,得Al(OH)3沉淀和碳酸氢钠,反应的离子方程式:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(3)本实验中需要通过氢氧化铝的质量、氧化铝样品的质量测定样品中氧化铝的质量分数,所以步骤Ⅳ需要干燥Al(OH)3沉淀并称量其质量,
故答案为:干燥Al(OH)3沉淀、称量;
(4)要测定铝土矿样品中Al2O3的质量分数,需要通过氢氧化铝沉淀的质量计算出氧化铝的质量,还应该知道样品的质量,设铝土矿样品的质量为xg、氢氧化铝的质量为y,根据质量守恒可知样品中氧化铝的质量为:$\frac{yg}{78g/mol}$×$\frac{1}{2}$×102g/mol=$\frac{102y}{156}$g,
则该铝土矿样品中氧化铝的质量分数为:$\frac{\frac{102y}{156}g}{xg}$×100%=$\frac{102y}{156x}$×100%,
故答案为:铝土矿样品质量xg、Al(OH)3质量y g;$\frac{102y}{156x}$×100%.
点评 本题考查了测量铝土矿中氧化铝的质量分数的方法,题目难度中等,明确发生反应原理及测量方法为解答关键,注意掌握化学实验基本操作方法及计算样品含量的方法,试题培养了学生的分析、理解能力及化学计算能力.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
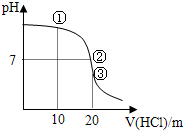
| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)=c(OH-)=c(H)+ | |
| C. | ③溶液:含有的微粒数为5种 | |
| D. | 滴定过程中可能出现:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.2mol•L-1的AlCl3溶液中,含阳离子数目小于0.02NA | |
| B. | 标况下30 L pH=11的Na2CO3溶液中含有的OH-数为0.03NA | |
| C. | 10 mL质量分数为98%的H2SO4溶液,用水稀释至100 mL,所得H2SO4的质量分数大于9.8% | |
| D. | 11 g超重水(T2O)含中子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论使用的石油、煤等传统能源,还是氢能、核能等新能源,归根结底这些能源都是由太阳能转而来 | |
| B. | 铝表面有一层致密的氧化物薄膜具有极强的抗腐蚀能力,故铝制容器可用来贮存酸碱性、腌制性食品等 | |
| C. | 生活中用草木灰制作松花蛋,农业上用福尔马林浸种,工业上用亚硝酸盐处理皮革等,其过程的共同点都是利用了蛋白质变性的性质 | |
| D. | 氯气、次氯酸盐、二氧化氯等含氯化合物都具有强氧化性,能用于杀菌消毒.氯化钾、氯酸钾也是含氯化合物,故也能用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为21的钾原子:${\;}_{19}^{40}$K | |
| B. | 氯化钡的电子式:Ba2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{ci}}{••}$${\;}_{•}^{•}$]${\;}_{2}^{-}$ | |
| C. | N3-的结构示意图: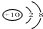 | |
| D. | 聚2-甲基-1,3-丁二烯的结构简式: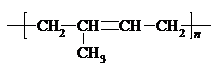 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的c(H+ )=l.0xl0-12 mol/L | |
| B. | c (CH3COOH)>c (H+ )>c (CH3COO- )>c (OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH (醋酸)<pH (盐酸) | |
| D. | 与等体积的氢氧化钠溶液反应:c (CH3COOH)+c (CH3COO- )=0.01mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com