
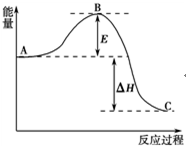
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:分析 (1)A表示反应物总能量,C表示生成物总能量;△H为反应热,E为活化能,活化能的大小与反应热无关;催化剂能够降低反应的活化能,不影响反应物和生成物能量高低;
(2)反应2SO2(g)+O2(g)?2SO3(g)中反应热表示2molSO2(g)放出的热量;
(3)V2O5氧化SO2时,自身被还原为四价钒化合物,即得到VO2与SO3,四价钒化合物再被氧气氧化为V2O5;
(4)单质硫的燃烧热为296kJ•mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,再根据盖斯定律计算.
解答 解:(1)图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为生成物总能量能、反应物总能量的大小之差,活化能的大小与反应热无关,
催化剂能够降低反应的活化能,加V2O5会使图中B点降低,因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热,
故答案为:反应物总能量;生成物总能量;无;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=2×(-99kJ•mol-1)=-198kJ•mol-1,故答案为:-198;
(3)V2O5氧化SO2时,自身被还原为四价钒化合物,即得到VO2与SO3,四价钒化合物再被氧气氧化为V2O5,反应方程式为:SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5,
故答案为:SO2+V2O5═SO3+2VO2;4VO2+O2═2V2O5;
(4)因单质硫的燃烧热为296kJ•mol-1,则①:S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,则②:SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
则根据盖斯定律,①×3+②×3可得:S(s)+$\frac{3}{2}$O2(g)=SO3(g),△H=3×[(-296kJ•mol-1)+(-99kJ•mol-1)]=-1185 KJ•mol-1,
答:由S(s)生成3molSO3(g)的△H为-1185 KJ•mol-1.
点评 本题考查反应热计算有关计算、反应中能量变化,侧重于学生的分析能力和计算能力的考查,注意催化剂对反应的影响以及盖斯定律的应用.


科目:高中化学 来源: 题型:选择题
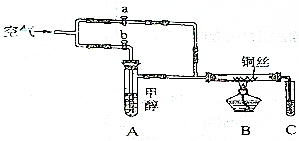 如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )
如图所示装置,通入空气,开启a、b两个活塞,灼热铜丝,下列有关分析正确的是( )| A. | 灼热铜丝发生的现象变化为紫红色和黑色交替出现,甲醇发生还原反应 | |
| B. | C中有机产物易溶于水,与水分子间只形成1种氢键 | |
| C. | 检验C中产物的试剂可用1mol•L-1的CuSO4溶液2mL和0.4mol•L-1的NaOH | |
| D. | 可用酸性高锰酸钾溶液检验产物生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
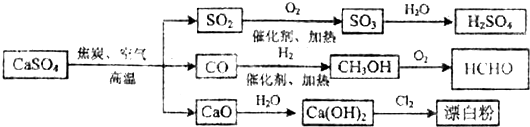
| A. | 除去与水反应外,图示中其它的转化反应均为氧化还原反应 | |
| B. | CO、SO2、SO3 均是酸性氧化物 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH 进而合成HCHO的两步反应,原子利用率均为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 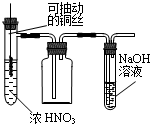 制取少量的NO2 | B. |  电解食盐水制氯气和氢气 | ||
| C. | 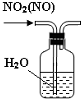 除去NO2中的NO | D. |  用二氧化锰和浓盐酸制氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝片与氧化铁混合加热进行铝热反应 | |
| B. | 将蔗糖溶于水,加热几分钟后再加人少量新制的Cu(OH)2就可实现将蔗糖水解,并用新制的Cu(OH)2检验蔗糖的水解产物 | |
| C. | 用溴的四氯化碳溶液就能鉴别乙烷与乙烯 | |
| D. | 向裂化汽油中加人酸性高锰酸钾溶液,振荡,紫色褪去说明汽油中含有甲苯等苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
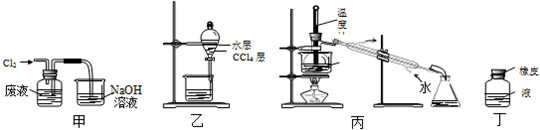
| A. | 用装置甲氧化废液中的溴化氢 | B. | 用装置乙分离CCl4层和水层 | ||
| C. | 用装置丙分离CCl4和液溴 | D. | 用仪器丁长期贮存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
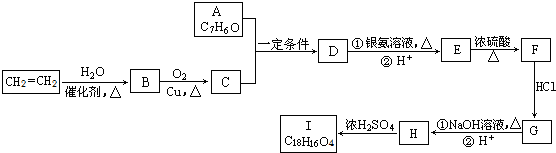
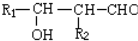
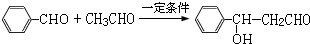 .
.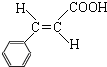 .
. .
.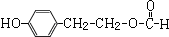
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3 COOH)=K(NH3•H2 O) | |
| D. | 该溶液中c(CH3 COO-)大于同浓度CH3 COONa溶液中的c(CH3 COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com