
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实
|
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含 mgFeSO4·7H2O为片剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
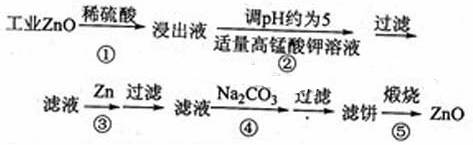
提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为
加高锰酸钾溶液前,若pH较低,对除杂的影响是
(2)反应③的反应类型为 .过滤得到的滤渣中,除了过量的锌外还有
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧
后可得到产品8.1 g. 则x等于
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com